Nový způsob podávání alirokumabu: 300 mg každé 4 týdny
New alirocumab dosing regimen: 300 mg every 4 weeks
Prof. MUDr. Petr Ošťádal, Ph.D. Komplexní kardiovaskulární centrum, Nemocnice Na Homolce, Praha
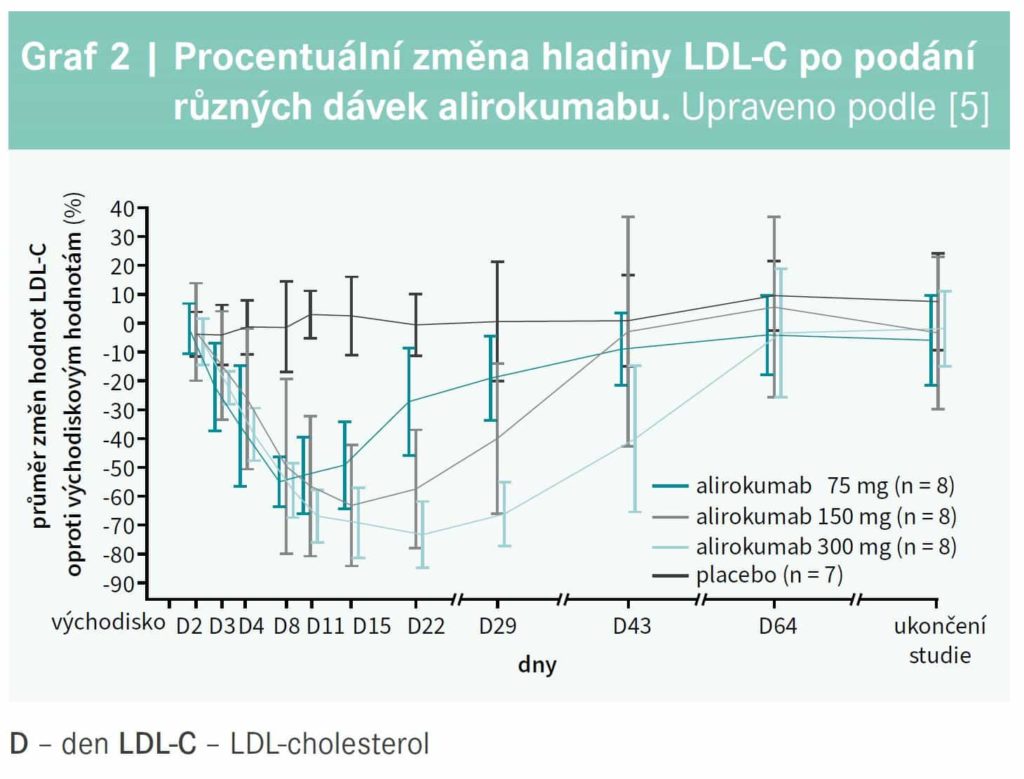
Abstrakt Inhibitor proprotein konvertázy subtilizin kexin typu 9 (PCSK9i) alirokumab se dosud používal v léčbě jako 75 mg či 150 mg subkutánní injekce, podávaná každé 2 týdny. Nově máme k dispozici i možnost podávat alirokumab ve formě jedné 300 mg injekce každé 4 týdny. Tento způsob léčby je podporován klinickými studiemi, které hodnotily farmakodynamický profil, účinnost a bezpečnost a také technické aspekty nově vyvinutého autoinjekčního pera. V článku je shrnuta dostupná evidence podporující léčbu alirokumabem 300 mg 1krát za 4 týdny. Klíčová slova: alirokumab – dávkování – proprotein konvertáza subtilizin kexin typu 9 (PCSK9) Abstract The proprotein convertase subtilisin kexin type 9 inhibitor (PCSK9) alirocumab has been used in the lipidlowering therapy as a 75 mg or 150 mg subcutaneous injection given every 2 weeks. Currently, alirocumab is available also as a single 300 mg injection for administration every 4 weeks. This dosing regimen is supported by clinical studies that have evaluated its pharmacodynamic profile, efficacy, safety and also technical aspects of the newly developed autoinjector. Present article summarizes the available evidence for treatment with alirocoumab 300 mg every 4 weeks. Key words: alirocumab – dosing regimen – proprotein convertase subtilisin kexin type 9 (PCSK9) Úvod Inhibitory proprotein konvertázy subtilizin kexin typu 9 (PCSK9i) v poslední době nalezly pevné místo mezi hypolipidemiky a prokázaly svoji účinnost v prevenci aterosklerózy. Výrazný pokles hladiny LDLcholesterolu (LDLC) a dalších aterogenních lipoproteinů vlivem PCSK9i (evolokumab a alirokumab) je prokazatelně spojen se zlepšením prognózy a se snížením rizika kardiovaskulární příhody, jak ukázala studie FOURIER u nemocných s chronickými formami aterosklerózy1 a studie ODYSSEYOUTCOMES u pacientů s akutním koronárním syndromem.2 Ve většině klinických studií 2. a 3. fáze byly PCSK9i podávány formou subkutánních injekcí v intervalu 2 týdnů, protože toto dávkovací schéma se zdálo být nejvýhodnější. Nicméně také na základě nových klinických studií byla nedávno uvedena na trh nová léková forma alirokumabu, a to 300 mg k podkožnímu podání jen 1krát za měsíc Nové farmakodynamické údaje V iniciálních fázích testování alirokumabu byly porovnávány různé dávky a dávkovací schémata a na základě těchto výsledků byla vybrána dávka 75 mg nebo 150 mg podávaná každé 2 týdny, jako optimální způsob léčby alirokumabem; ale i v těchto studiích byl alirokumab podávaný 300 mg 1krát za 4 týdny účinnou alternativou.3,4 V posledních letech se objevily nové práce podporující toto doposud v klinice nepo užívané dávkovací schéma. Nedávno byla publikovaná farmakokinetická a farmakodynamická klinická studie, která byla provedena u 31 zdravých Číňanů s hladinou LDLC > 100 mg/dl (2,6 mmol/l).5 Účastníci studie byli randomizováni k podání 1 dávky alirokumabu 75 mg, 150 mg či 300 mg nebo dostali placebo. Po všech dávkách alirokumabu klesla hladina volné PCSK9 k nule, přičemž blízko nulovým hodnotám zůstala i 11 dnů od podání 75 mg, resp. 15 dnů od podání 150 mg a 29 dnů od aplikace 300 mg alirokumabu (graf 1). Maximálního snížení LDLC bylo podávce 75 mg alirokumabu dosaženo 8. den (redukce o 55,3 %), po dávce 150 mg 15. den (redukce o 63,7 %) a po dávce 300 mg alirokumabu byla nejnižší hodnota LDL-C po 22 dnech od podání (redukce o 73,7 %), graf 2.
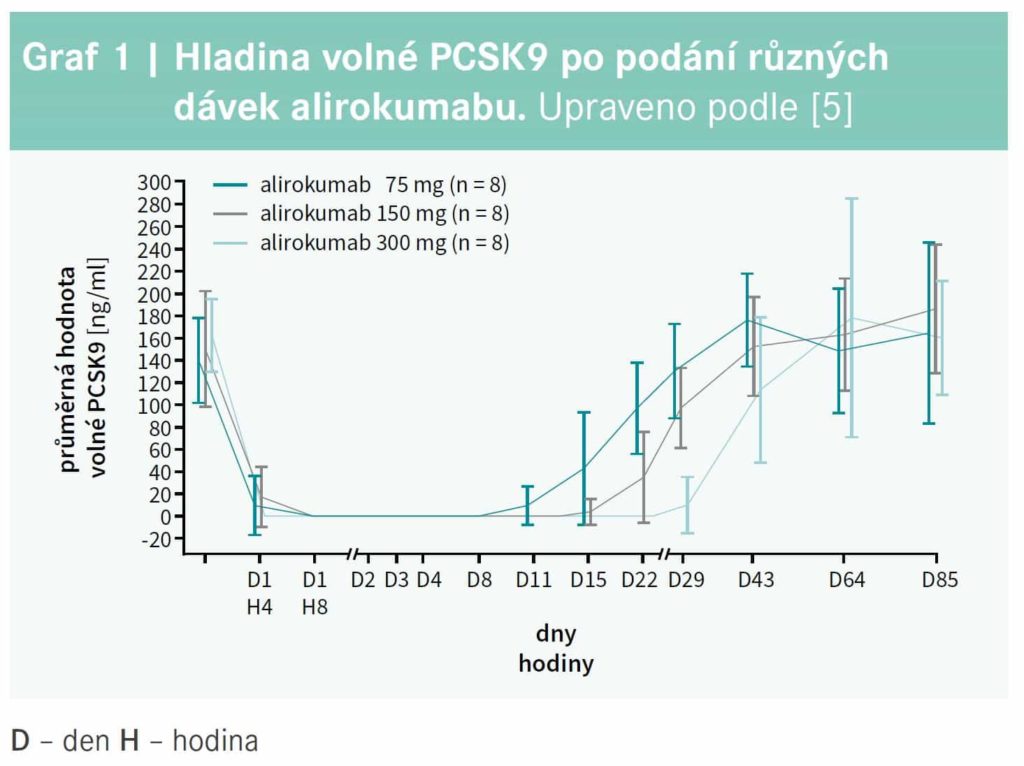 V této studii se objevila pouze jediná lehká reakce v místě vpichu po aplikaci 300 mg alirokumabu a nebyly zaznamenány žádné závažnější nežádoucí účinky.
V této studii se objevila pouze jediná lehká reakce v místě vpichu po aplikaci 300 mg alirokumabu a nebyly zaznamenány žádné závažnější nežádoucí účinky.
 Farmakodynamická data tedy jednoznačně podporují podání alirokumabu v dávce 300 mg každé 4 týdny.
Studie ODYSSEY CHOICE I
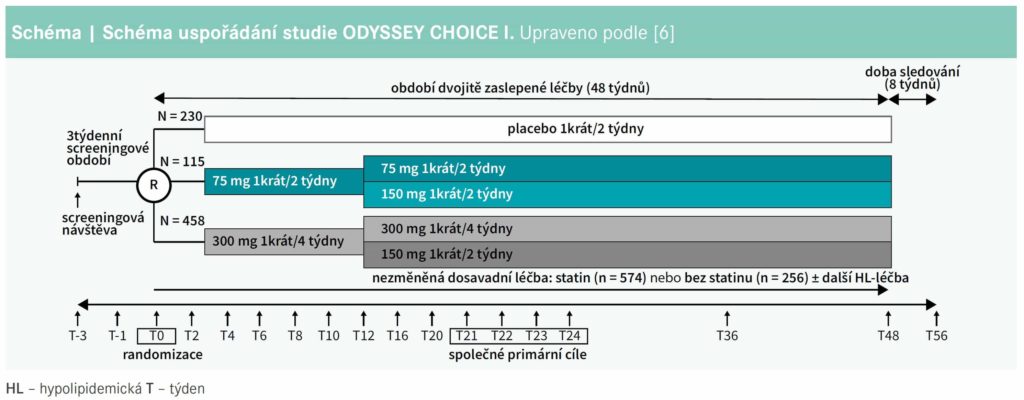
Hypolipidemické účinky alirokumabu podávaného v dávce 300 mg 1krát měsíčně byly testovány v klinické studii ODYSSEY CHOICE I.6,7 Jednalo se o randomizovanou dvojitě zaslepenou placebem kontrolovanou studii, do níž bylo zařazeno více než 800 nemocných, u kterých zůstávala hladina LDLC > 1,8 mmol/l (při velmi vysokém kardiovaskulárním riziku) nebo > 2,6 mmol/l (střední nebo vysoké riziko). Většina nemocných byla léčena maximální tolerovanou dávkou statinu. Nemocní byli randomizováni k podávání placeba, alirokumabu 75 mg každé 2 týdny nebo 300 mg každé 4 týdny; po 12 týdnech léčby při nedosažení cílové hodnoty LDLC byla možná úprava léčby alirokumabem na dávku 150 mg každé 2 týdny. Ve studii byly 2 primární cílové ukazatele – jednak změna hladiny LDLC po 24 týdnech léčby, jednak průměrná hladina LDLC v týdnech 21–24 (schéma).
Farmakodynamická data tedy jednoznačně podporují podání alirokumabu v dávce 300 mg každé 4 týdny.
Studie ODYSSEY CHOICE I
Hypolipidemické účinky alirokumabu podávaného v dávce 300 mg 1krát měsíčně byly testovány v klinické studii ODYSSEY CHOICE I.6,7 Jednalo se o randomizovanou dvojitě zaslepenou placebem kontrolovanou studii, do níž bylo zařazeno více než 800 nemocných, u kterých zůstávala hladina LDLC > 1,8 mmol/l (při velmi vysokém kardiovaskulárním riziku) nebo > 2,6 mmol/l (střední nebo vysoké riziko). Většina nemocných byla léčena maximální tolerovanou dávkou statinu. Nemocní byli randomizováni k podávání placeba, alirokumabu 75 mg každé 2 týdny nebo 300 mg každé 4 týdny; po 12 týdnech léčby při nedosažení cílové hodnoty LDLC byla možná úprava léčby alirokumabem na dávku 150 mg každé 2 týdny. Ve studii byly 2 primární cílové ukazatele – jednak změna hladiny LDLC po 24 týdnech léčby, jednak průměrná hladina LDLC v týdnech 21–24 (schéma).
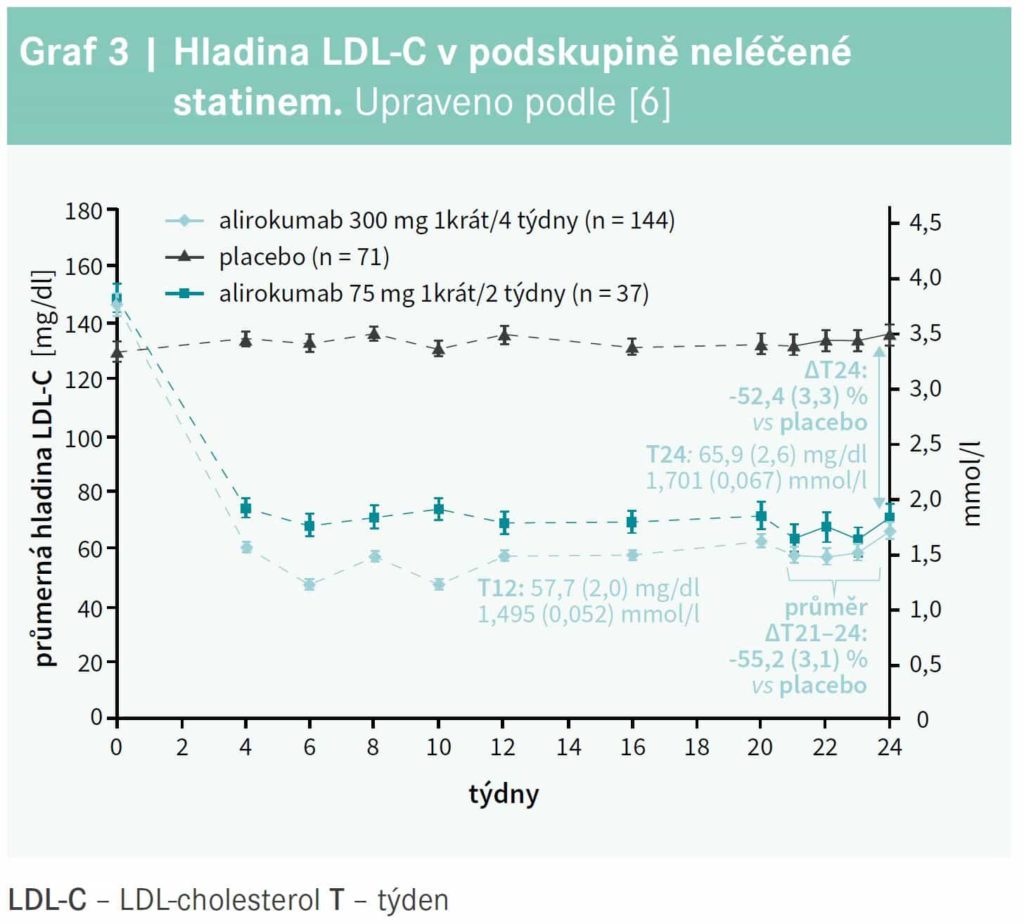
 V této práci byla zvlášť hodnocena podskupina nemocných léčených statinem, a zvlášť jedinci bez statinové léčby. V podskupině bez statinu došlo účinkem alirokumabu 300 mg 1krát/4 týdny k poklesu LDL-C po 24 týdnech o 52,4 % ve srovnání s placebem (p < 0,0001) a průměrná hodnota LDL-C v týdnech 21–24 byla nižší o 55,2 % (p < 0,0001), graf 3.
V této práci byla zvlášť hodnocena podskupina nemocných léčených statinem, a zvlášť jedinci bez statinové léčby. V podskupině bez statinu došlo účinkem alirokumabu 300 mg 1krát/4 týdny k poklesu LDL-C po 24 týdnech o 52,4 % ve srovnání s placebem (p < 0,0001) a průměrná hodnota LDL-C v týdnech 21–24 byla nižší o 55,2 % (p < 0,0001), graf 3.
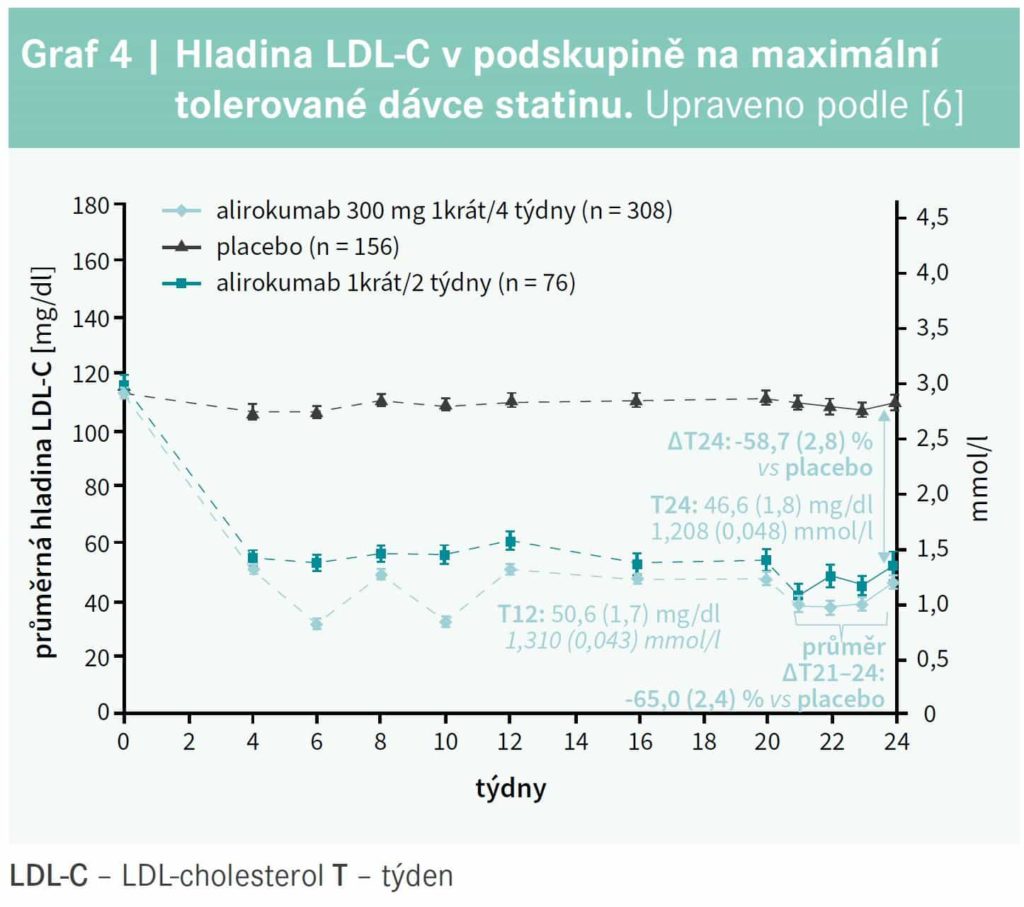
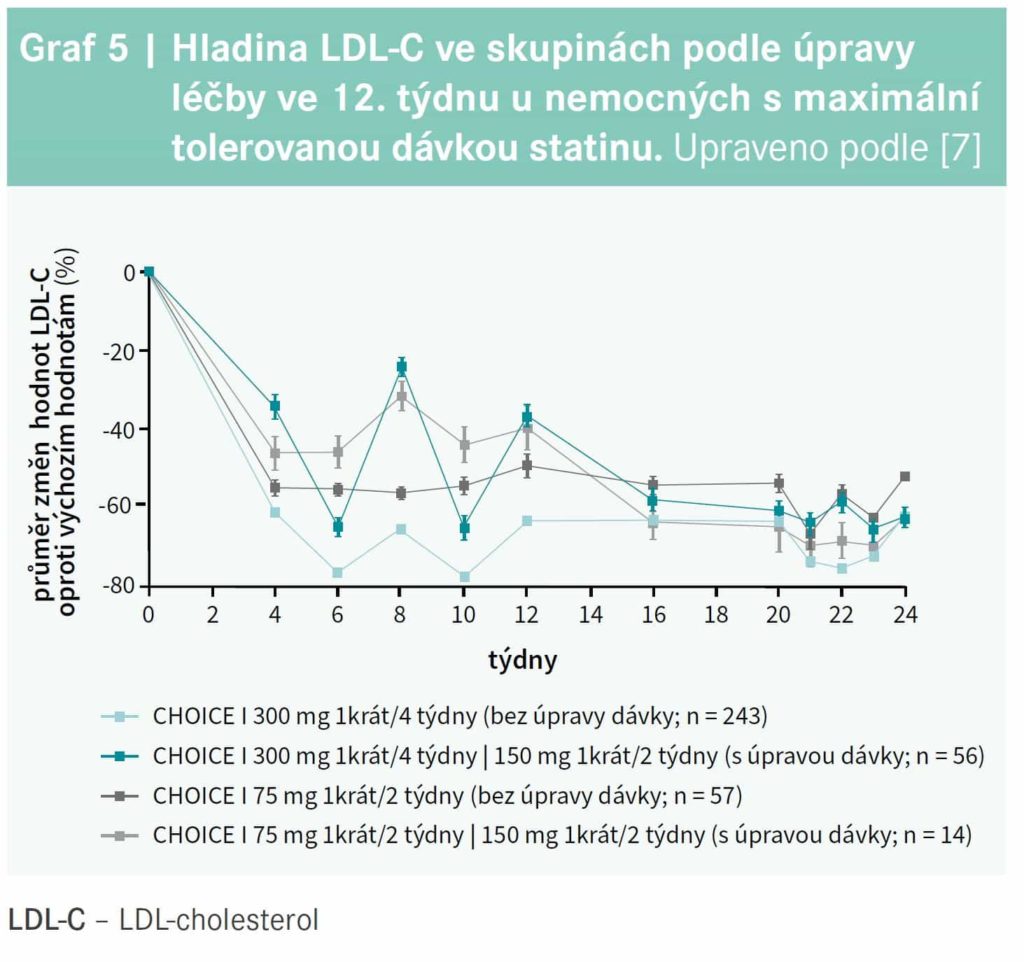
 V podskupině jedinců užívajících maximální tolerovanou dávku statinu snížil alirokumab v dávce 300 mg 1krát/4 týdny LDLC po 24 týdnech o 58,7 % ve srovnání s placebem (p < 0,0001) a průměrnou hodnotu LDLC v týdnech 21–24 dokonce o 65,0 % (p < 0,0001), graf 4. U nemocných, kteří vyžadovali úpravu léčby podle protokolu, byla po 12 týdnech výrazně vyšší hladina LDLC v obou skupinách s alirokumabem; zatímco u jedinců dosud léčených 75 mg každé 2 týdny zvýšení dávky na 150 mg každé 2 týdny vedlo k výraznému poklesu LDLC, v podskupině s 300 mg alirokumabu každé 4 týdny stejná úprava léčby (změna na 150 mg každé 2 týdny) ovlivnila LDLC méně (graf 5).
V podskupině jedinců užívajících maximální tolerovanou dávku statinu snížil alirokumab v dávce 300 mg 1krát/4 týdny LDLC po 24 týdnech o 58,7 % ve srovnání s placebem (p < 0,0001) a průměrnou hodnotu LDLC v týdnech 21–24 dokonce o 65,0 % (p < 0,0001), graf 4. U nemocných, kteří vyžadovali úpravu léčby podle protokolu, byla po 12 týdnech výrazně vyšší hladina LDLC v obou skupinách s alirokumabem; zatímco u jedinců dosud léčených 75 mg každé 2 týdny zvýšení dávky na 150 mg každé 2 týdny vedlo k výraznému poklesu LDLC, v podskupině s 300 mg alirokumabu každé 4 týdny stejná úprava léčby (změna na 150 mg každé 2 týdny) ovlivnila LDLC méně (graf 5).
 Ve studii ODYSSEY CHOICE I nebyl pozorován vyšší výskyt nežádoucích účinků po podání alirokumabu v dávce 300 mg s jedinou výjimkou, a tou bylo více reakcí v místě vpichu po dávce 300 mg alirokumabu nejen ve srovnání s placebem, ale i ve srovnání s předchozími zkušenostmi. Vysvětlením je skutečnost, že alirokumab 300 mg byl ve studii ODYSSEY CHOCE I podáván ve formě dvou 150 mg injekcí; po přepočítání reakcí v místě vpichu na počet aplikovaných injekcí byl výskyt podobný jako v předchozích studiích.
Ve studii ODYSSEY CHOICE I nebyl pozorován vyšší výskyt nežádoucích účinků po podání alirokumabu v dávce 300 mg s jedinou výjimkou, a tou bylo více reakcí v místě vpichu po dávce 300 mg alirokumabu nejen ve srovnání s placebem, ale i ve srovnání s předchozími zkušenostmi. Vysvětlením je skutečnost, že alirokumab 300 mg byl ve studii ODYSSEY CHOCE I podáván ve formě dvou 150 mg injekcí; po přepočítání reakcí v místě vpichu na počet aplikovaných injekcí byl výskyt podobný jako v předchozích studiích.
 Studie ODYSSEY CHOCE I tedy prokázala bezpečnost a výrazné hypolipidemické účinky alirokumabu podávaného v dávce 300 mg 1krát za 4 týdny, a také tato práce tedy podporuje nové dávkovací schéma.6,7
Studie SYDNEY
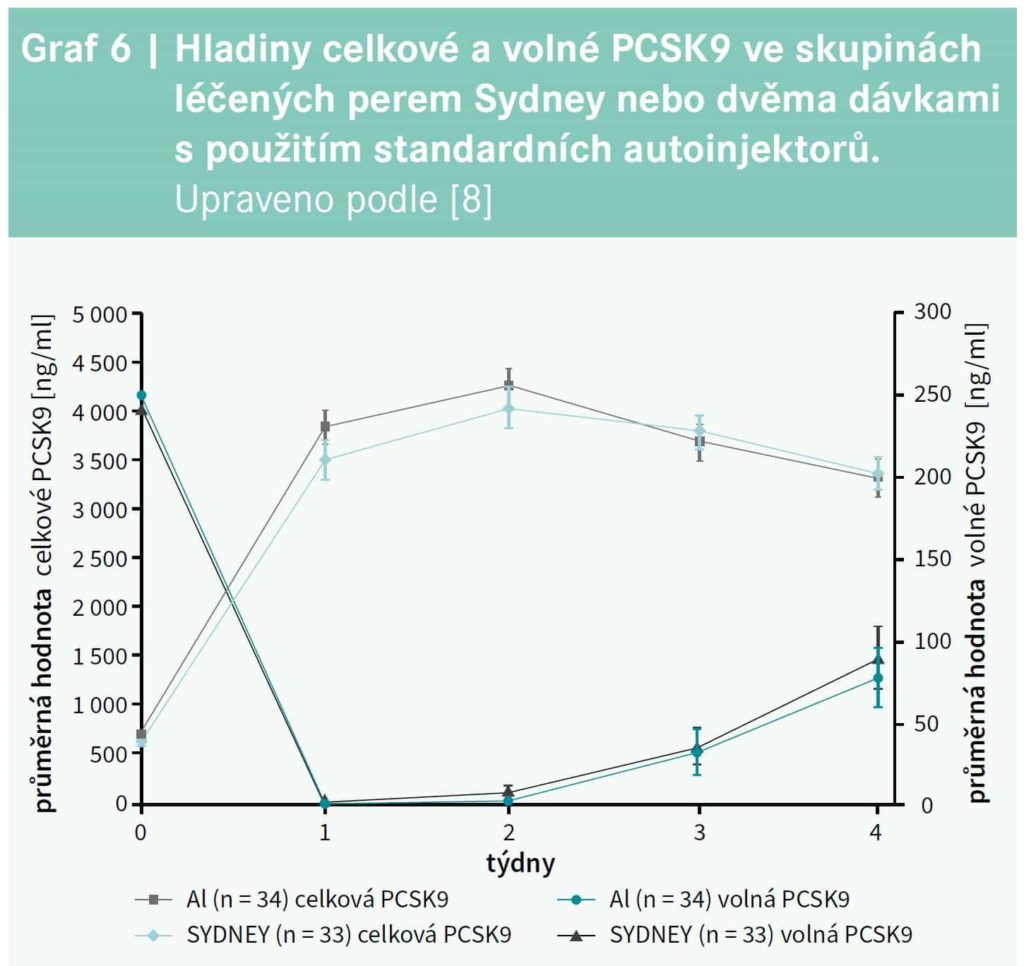
Jak bylo uvedeno výše, ve studii ODYSSEY CHOCE I byl alirokumab 300 mg podáván formou dvou 150 mg injekcí. Nedávno však bylo vyvinuto nové injekční pero Sydney, které umožňuje podání 300 mg alirokumabu (2 ml) v 1 injekci za dobu kratší než 20 sekund. Technické aspekty autoinjekčního pera Sydney byly testovány ve stejně pojmenované randomizované otevřené studii (studie SYDNEY) u nemocných s hypercholesterolemií (N = 69).8 Ti byli randomizováni k podání 300 mg alirokumabu cestou dvou 150 mg injekcí nebo s použitím pera Sydney k aplikaci jedné 300 mg injekce. Po 4 týdnech byli dále všichni pacienti léčeni s použitím pera Sydney. Průměrné hladiny volné a celkové PCSK9 byly srovnatelné po aplikaci 1krát 300 mg nebo 2krát 150 mg alirokumabu (graf 6). Studie SYDNEY ukázala, že alirokumab 300 mg podaný v jedné 2ml injekci výrazně snížil hladinu LDLC (o 66,2 %) bez technických komplikací či technických nedostatků. Alirokumab 300 mg 1krát za 4 týdny v 1 injekci byl dobře tolerován bez nových nežádoucích příznaků ve srovnání s dnes běžnými 1ml injekčními pery. Účastníci studie také vyplňovali dotazníky o zkušenostech s aplikací pomocí injekčního pera Sydney. Většina shledala použití pera jako „velmi jednoduché“ s průměrným skóre ≥ 9,8 na stupnici 1 až 10 a současně většina byla s aplikací „velmi spokojena“ s průměrným skóre ≥ 9,7 na stupnici 1 až 10.
Studie ODYSSEY CHOCE I tedy prokázala bezpečnost a výrazné hypolipidemické účinky alirokumabu podávaného v dávce 300 mg 1krát za 4 týdny, a také tato práce tedy podporuje nové dávkovací schéma.6,7
Studie SYDNEY
Jak bylo uvedeno výše, ve studii ODYSSEY CHOCE I byl alirokumab 300 mg podáván formou dvou 150 mg injekcí. Nedávno však bylo vyvinuto nové injekční pero Sydney, které umožňuje podání 300 mg alirokumabu (2 ml) v 1 injekci za dobu kratší než 20 sekund. Technické aspekty autoinjekčního pera Sydney byly testovány ve stejně pojmenované randomizované otevřené studii (studie SYDNEY) u nemocných s hypercholesterolemií (N = 69).8 Ti byli randomizováni k podání 300 mg alirokumabu cestou dvou 150 mg injekcí nebo s použitím pera Sydney k aplikaci jedné 300 mg injekce. Po 4 týdnech byli dále všichni pacienti léčeni s použitím pera Sydney. Průměrné hladiny volné a celkové PCSK9 byly srovnatelné po aplikaci 1krát 300 mg nebo 2krát 150 mg alirokumabu (graf 6). Studie SYDNEY ukázala, že alirokumab 300 mg podaný v jedné 2ml injekci výrazně snížil hladinu LDLC (o 66,2 %) bez technických komplikací či technických nedostatků. Alirokumab 300 mg 1krát za 4 týdny v 1 injekci byl dobře tolerován bez nových nežádoucích příznaků ve srovnání s dnes běžnými 1ml injekčními pery. Účastníci studie také vyplňovali dotazníky o zkušenostech s aplikací pomocí injekčního pera Sydney. Většina shledala použití pera jako „velmi jednoduché“ s průměrným skóre ≥ 9,8 na stupnici 1 až 10 a současně většina byla s aplikací „velmi spokojena“ s průměrným skóre ≥ 9,7 na stupnici 1 až 10.
 Studie SYDNEY tedy ukázala, že aplikace 300 mg alirokumabu formou 1 injekce s použitím 2ml autoinjekčního pera Sydney je bezpečná a uživatelsky přívětivá.8
Závěr
Dostupna evidence naznačuje, že podavani 300 mg alirokumabu 1krat za 4 tydny představuje novou alternativu lečby PCSK9i, ktera může byt vyhodna zvlaště u nemocnych, u nichž je požadovano sniženi LDL-C o vice než 60 %.
Podpořeno grantem MZ ČR – RVO (NNH, 0023884) IG 150501.
Článok bol prevzatý a uverejnený so súhlasom autora a odbornej redakcie Atheroreview a zároveň prevzatý s láskavým súhlasom hlavného odborného redaktora prof. M. Vrablíka a vydavateľstva Facta Medica, s. r. o. Článok bol po prvý krát uverejnený v časopise AtheroRev 2021; 6(2): 103–107.
Literatura
Studie SYDNEY tedy ukázala, že aplikace 300 mg alirokumabu formou 1 injekce s použitím 2ml autoinjekčního pera Sydney je bezpečná a uživatelsky přívětivá.8
Závěr
Dostupna evidence naznačuje, že podavani 300 mg alirokumabu 1krat za 4 tydny představuje novou alternativu lečby PCSK9i, ktera může byt vyhodna zvlaště u nemocnych, u nichž je požadovano sniženi LDL-C o vice než 60 %.
Podpořeno grantem MZ ČR – RVO (NNH, 0023884) IG 150501.
Článok bol prevzatý a uverejnený so súhlasom autora a odbornej redakcie Atheroreview a zároveň prevzatý s láskavým súhlasom hlavného odborného redaktora prof. M. Vrablíka a vydavateľstva Facta Medica, s. r. o. Článok bol po prvý krát uverejnený v časopise AtheroRev 2021; 6(2): 103–107.
Literatura
- Sabatine MS, Giugliano RP, Keech AC et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med 2017; 376(18): 1713–1722. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1615664>.
- Schwartz GG, Steg PG, Szarek M et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med 2018; 379(22): 2097–2107. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1801174>.
- McKenney JM, Koren MJ, Kereiakes DJ et al. Safety and efficacy of a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 serine protease, SAR236553/REGN727, in patients with primary hypercholesterolemia receiving ongoing stable atorvastatin therapy. J Am Coll Cardiol 2012; 59(25): 2344–2353. Dostupné z DOI: <http://dx.doi.org/10.1016/j. jacc.2012.03.007>.
- Stein EA, Gipe D, Bergeron J et al. Effect of a monoclonal antibody to PCSK9, REGN727/SAR236553, to reduce low-density lipoprotein cholesterol in patients with heterozygous familial hypercholesterolaemia on stable statin dose with or without ezetimibe therapy: a phase 2 randomised controlled trial. Lancet 2012; 380(9836): 29–36. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(12)60771–5>.
- Li H, Wei Y, Yang Z et al. Safety, Tolerability, Pharmacokinetics, and Pharmacodynamics of Alirocumab in Healthy Chinese Subjects: A Randomized, Double-Blind, Placebo-Controlled, Ascending Single-Dose Study. Am J Cardiovasc Drugs 2020; 20(5): 489–503. Dostupné z DOI: <http://dx.doi.org/10.1007/s40256–020–00394–1>.
- Roth EM, Moriarty PM, Bergeron J et al. A phase III randomized trial evaluating alirocumab 300 mg every 4 weeks as monotherapy or add-on to statin: ODYSSEY CHOICE I. Atherosclerosis 2016; 254: 254–262. Dostupné z DOI: <http://dx.doi.org/10.1016/j.atherosclerosis.2016.08.043>.
- Roth EM, Kastelein JJP, Cannon CP et al. Pharmacodynamic relationship between PCSK9, alirocumab, and LDL-C lowering in the ODYSSEY CHOICE I trial. J Clin Lipidol 2020; 14(5): 707–719. Dostupné z DOI: <http://dx.doi. org/10.1016/j.jacl.2020.07.009>.
- Frias JP, Koren MJ, Loizeau V et al. The SYDNEY Device Study: A Multicenter, Randomized, Open-label Usability Study of a 2-mL Alirocumab Autoinjector Device. Clin Ther 2020; 42(1): 94–107.e5. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clinthera.2019.11.008>.


