Diabetik na kortikoidnej liečbe – Je inzulínová rezistencia neprekonateľný múr?
MUDr. Emil Fraenkel, PhD I. interná klinika UNLP, Košice
V kazuistike prezentujem pacienta s preexistujúcim metabolickým syndrómom, u ktorého následkom dlhodobej kortikoidnej liečby došlo ku klinickej manifestácii diabetu. Úvod Diabetogénny efekt kortikoidov je dlhodobo známy a prejavuje sa na úrovni pečene, pankreasu, svalov aj tukového tkaniva. Kým na úrovni pečene dochádza k indukcii glukoneogenézy a glykolýzy dôsledkom inzulínovej rezistencie (IR) navodenej kortikoidmi, v pankrease hrá hlavnú rolu glukotoxický účinok na beta-bunky dôsledkom hyperglykémie aj stimulácia produkcie glukagónu kortikoidmi, vo svaloch je narušená utilizácia glukózy, v tukovom tkanive dochádza k zvýšenému uvoľňovaniu VMK v dôsledku zvýšenej lipolytickej aktivity pre zvýšenú aktivitu hormónsenzitívnej lipázy pri nedostatočnej aktivite inzulínu. Takto uvoľnené VMK ďalej prehlbujú IR. Problematiku ďalej komplikuje aj skutočnosť, že kortikoidy sa podávajú pacientom s aktívnymi zápalovými ochoreniami, pričom úroveň inflamatórnych zmien sama osebe zhoršuje inzulínovú senzitivitu.
Pri kortikoliečbe sa typicky ako prvá objavuje postprandiálna hyperglykémia, preto sa terapeutický prístup má zamerať najmä týmto smerom. Taktika liečby sa má prispôsobiť aj tomu, či sa u pacienta plánuje dlhodobá kortikoliečba, alebo iba nárazové dávky kortikoidov. V praxi sa najčastejšie uplatňuje podávanie prandiálneho inzulínu niekoľkokrát denne
v závislosti od dennej doby podávania kortikoliečby, čo je obmedzené aj spoluprácou pacienta, keďže ide často o pacientov, ktorí predtým nemali diabetes, a preto na inzulínovú liečbu často nie sú pripravení ani psychicky. Ďalším problémom je, že pri väčšine režimov kortikoidnej liečby ide o postupne klesajúce dávky, čo predstavuje pri nezmenených dávkach inzulínu ďalšie riziko hypoglykémie. Pri kortikoidoch s krátkodobým účinkom, ako napr. pri prednisone per os najčastejšie podávanom ráno sa jeho hyperglykemizujúci účinok prejavuje asi o 4 hodiny a odznieva do 12 hodín, čo môže mať pri intenzifikovanej inzulínovej liečbe za následok vyššie riziko hypoglykémie v nočných hodinách, platí to aj pre preparáty sulfonylurey.
Terapeutickou voľbou pre týchto pacientov môžu byť GLP-1 analógy, pretože majú glukózodependentný účinok, pôsobia na úrovni pankreasu a v prípade krátko účinkujúcich preparátov, ako je lixisenatid, aj na úrovni spomalenia vyprázdňovania žalúdka.
Kazuistika
74-ročný obézny pacient (výška 170 cm, váha 90 kg, BMI 31 kg/m², obvod pása 102 cm), hypertonik s 10-ročnou anamnézou polymyalgia rheumatica na kortikoidnej liečbe a liečbe chlorochínom a NSAID k nám bol odoslaný pre hyperglykémiu nalačno 10,2 mmol/l zistenú pri dávke prednisonu 5 mg denne v decembri 2014. V popredí subjektívnych ťažkostí pacienta dominovala únavnosť, občasné edémy proximálnych MTP kĺbov, bolesti ramien, epizódy palpitácií a chrápanie, čo sa pripisovalo Pickwickovmu syndrómu. V liečbe hypertenzie užíval pôvodne losartan/HCT 50/25 mg denne, pre nepriaznivý efekt HCT na metabolizmus sacharidov sme ho však vymenili za preparát bez diuretickej zložky. V rodinnej anamnéze bola hypertenzia zo strany matky a patologická obezita zo strany otca, ktorý zomrel na následky IM vo veku 64 rokov.
Stav sme hodnotili ako novozistený DM 2. typu (C-peptid 3,73 µg/l, negatívne autoprotilátky anti-GAD, HbA1c 6,5 % DCCT), hodnoty lipidového profilu však nespĺňali ATP III kritériá metabolického syndrómu (TAG 1,7 mmol/l, cholesterol 6,19 mmol/l, HDL-CH 1,25 mmol/l, LDL-CH 4,16 mmol/l, KM 370 µmol/l).
Problematiku ďalej komplikuje aj skutočnosť, že kortikoidy sa podávajú pacientom s aktívnymi zápalovými ochoreniami, pričom úroveň inflamatórnych zmien sama osebe zhoršuje inzulínovú senzitivitu.
Pri kortikoliečbe sa typicky ako prvá objavuje postprandiálna hyperglykémia, preto sa terapeutický prístup má zamerať najmä týmto smerom. Taktika liečby sa má prispôsobiť aj tomu, či sa u pacienta plánuje dlhodobá kortikoliečba, alebo iba nárazové dávky kortikoidov. V praxi sa najčastejšie uplatňuje podávanie prandiálneho inzulínu niekoľkokrát denne
v závislosti od dennej doby podávania kortikoliečby, čo je obmedzené aj spoluprácou pacienta, keďže ide často o pacientov, ktorí predtým nemali diabetes, a preto na inzulínovú liečbu často nie sú pripravení ani psychicky. Ďalším problémom je, že pri väčšine režimov kortikoidnej liečby ide o postupne klesajúce dávky, čo predstavuje pri nezmenených dávkach inzulínu ďalšie riziko hypoglykémie. Pri kortikoidoch s krátkodobým účinkom, ako napr. pri prednisone per os najčastejšie podávanom ráno sa jeho hyperglykemizujúci účinok prejavuje asi o 4 hodiny a odznieva do 12 hodín, čo môže mať pri intenzifikovanej inzulínovej liečbe za následok vyššie riziko hypoglykémie v nočných hodinách, platí to aj pre preparáty sulfonylurey.
Terapeutickou voľbou pre týchto pacientov môžu byť GLP-1 analógy, pretože majú glukózodependentný účinok, pôsobia na úrovni pankreasu a v prípade krátko účinkujúcich preparátov, ako je lixisenatid, aj na úrovni spomalenia vyprázdňovania žalúdka.
Kazuistika
74-ročný obézny pacient (výška 170 cm, váha 90 kg, BMI 31 kg/m², obvod pása 102 cm), hypertonik s 10-ročnou anamnézou polymyalgia rheumatica na kortikoidnej liečbe a liečbe chlorochínom a NSAID k nám bol odoslaný pre hyperglykémiu nalačno 10,2 mmol/l zistenú pri dávke prednisonu 5 mg denne v decembri 2014. V popredí subjektívnych ťažkostí pacienta dominovala únavnosť, občasné edémy proximálnych MTP kĺbov, bolesti ramien, epizódy palpitácií a chrápanie, čo sa pripisovalo Pickwickovmu syndrómu. V liečbe hypertenzie užíval pôvodne losartan/HCT 50/25 mg denne, pre nepriaznivý efekt HCT na metabolizmus sacharidov sme ho však vymenili za preparát bez diuretickej zložky. V rodinnej anamnéze bola hypertenzia zo strany matky a patologická obezita zo strany otca, ktorý zomrel na následky IM vo veku 64 rokov.
Stav sme hodnotili ako novozistený DM 2. typu (C-peptid 3,73 µg/l, negatívne autoprotilátky anti-GAD, HbA1c 6,5 % DCCT), hodnoty lipidového profilu však nespĺňali ATP III kritériá metabolického syndrómu (TAG 1,7 mmol/l, cholesterol 6,19 mmol/l, HDL-CH 1,25 mmol/l, LDL-CH 4,16 mmol/l, KM 370 µmol/l).
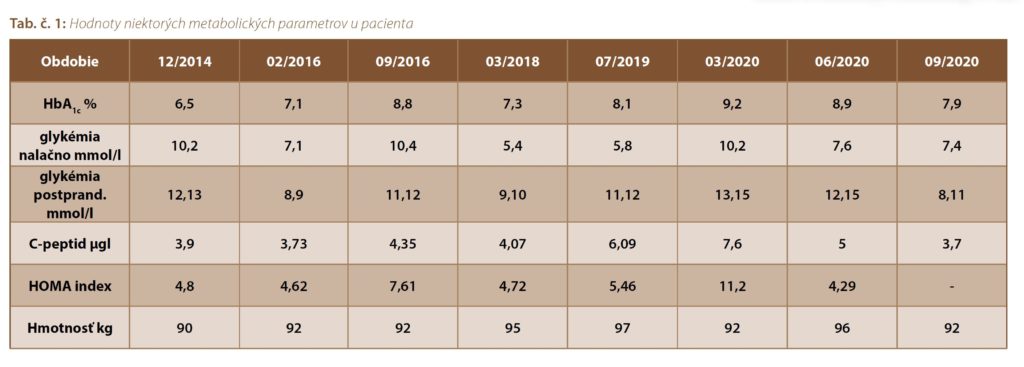 Ako úvodná liečba bol v decembri 2014 pacientovi nasadený metformín v dávke 2 500 mg denne, pacient sa dostavil na ďalšiu kontrolu až po vyše roku vo februári 2016. Dávka prednisonu bola rovnaká, pacient však mal horšiu metabolickú kompenzáciu diabetu (glc 7,1 mmol/l, HbA1c 7,1 % DCCT, hmotnosť 92 kg). Do liečby bol pridaný linagliptín v dávke 5 mg.
Pri návšteve v septembri 2016 sme však zistili ďalšie zhoršenie metabolickej kompenzácie diabetu (glc 10,4 mmol/l, HbA1c 8,8 % DCCT, hmotnosť 92 kg). Pacientovi bolo ponúknuté pridanie bazálneho inzulínu, ktorý však odmietol, preto sme sa rozhodli pridať preparát sulfonylurey (gliklazid v dávke 60 mg) a linagliptín vymenili za kombináciu metformínu a sitagliptínu v dávke 50/1 000 mg. Pri tejto kombinácii sa podarilo pacienta udržať na hodnote HbA1c v rozmedzí 6,3 až 7,0 % s minimálnymi odchýlkami asi 1,5 roka, od marca roku 2018 sme však zaznamenali plynulý vzostup HbA1c až na hodnotu 8,1 %. Počas celého obdobia však dominovalo zhoršenie v zmysle postprandiálnej glykémie, čo potvrdili aj záznamy zo selfmonitoringu pacienta, glykémie nalačno boli v rozmedzí do 7 mmol/l, čo korešpondovalo s charakteristikami diabetu navodeného kortikoliečbou. Pacient naďalej odmietal pridanie bazálneho inzulínu, k jeho váhovému prírastku na 97 kg prispelo aj predchádzajúce navýšenie dávky gliklazidu na maximálnu dávku 120 mg.
V júli roku 2019 sme sa rozhodli pridať empagliflozín v dávke 10 mg, hodnota HbA1c sa však napriek jeho ďalšiemu navýšeniu na 25 mg naďalej udržiavala v rozmedzí 7,5 – 8,1 %, pričom hodnoty glykémií nalačno boli okolo 4,5 až 5,5 mmol/l.
Pri kontrole v marci 2020 sme zistili hodnotu HbA1c 9,2 %, vysoká však bola aj hodnota glykémie nalačno (10,2 mmol/l), pričom hodnota C-peptidu bola až 7,6 µg/l a hladina inzulínu nalačno až 25 mIU/l (HOMA index 11,2). Všetky tieto hodnoty svedčili o tom, že u pacienta sa rozvinula inzulínová rezistencia, ktorá už šla nielen na vrub predchádzajúcej kortikoidnej liečby.
Vzhľadom na to, že pacient pre inzulínovú rezistenciu a vyššiu glykémiu nalačno potreboval pridanie aspoň bazálneho inzulínu, s jeho súhlasom sme pridali bazálny inzulínový analóg glargín 300 U/ml v počiatočnej dávke 12 j., túto dávku sme podľa hodnoty rannej glykémie nalačno vytitrovali až na hodnotu 20 j. Keďže naďalej pretrvávala diskrepancia v prospech postprandiálnej glykémie, v júni 2020 sme sa rozhodli pre kombináciu glargín 100 U/ml + lixisenatid. Na úvod sme zvolili žlté pero iGlarLixi a dávku sme postupne vytitrovali na 24 j. Súčasne sme z liečby vynechali sitagliptín a aj empagliflozín. Pri poslednej kontrole v septembri 2020 sme zaznamenali hodnotu HbA1c 7,9 %, pričom postprandiálne glykémie sa darí udržiavať v rozmedzí hodnôt 8 až 11 mmol/l a hodnota C-peptidu klesla na 3,7 µg/l, čo svedčí o zlepšení inzulínovej senzitivity. Kompenzáciu DM sa darí udržiavať v prijateľnom rozmedzí napriek tomu, že pacient má zatiaľ váhavý postoj k intenzifikácii inzulínovej liečby.
Diskusia
Išlo o pacienta, u ktorého sa prejavuje kombinovaný účinok metabolického syndrómu a následnej kortikoidnej liečby na inzulínovú rezistenciu. V čase, keď po vyčerpaní možností PAD liečby u pacienta už došlo k vzostupu glykémie nalačno, sme museli pristúpiť k pridaniu bazálneho inzulínu. Keďže v prípade DM potencovaného kortikoidnou liečbou ide dominantne o vzostup postprandiálnej glykémie, hľadali sme možnosť adekvátneho prístupu, aby sme sa vyhli viacnásobnému podávaniu inzulínu pri intenzifikovaní liečby. GLP-1 analógy sú podľa najnovších odporúčaní liekom voľby u pacientov s vyšším kardiovaskulárnym rizikom. Lixisenatid patrí medzi GLP-1 analógy s krátkodobým účinkom. Pri podávaní fixnej kombinácie lixisenatidu a bazálneho inzulínového analógu sa ich účinky navzájom dopĺňajú: kým úlohou bazálneho analógu je tlmenie hepatálnej produkcie glukózy, lixisenatid popri známych efektoch ostatných GLP-1 analógov znižuje výrazne postprandiálnu glykémiu aj spomalením vyprázdňovania žalúdka, čím sa líši od GLP-1 analógov s pomalým účinkom. Napriek tomu, že jeho efekt na pokles glykémií nalačno je menej výrazný ako v prípade dlho účinkujúcich GLP-1 analógov, na postprandiálny vzostup glykémie má popri prandiálnych inzulínových analógoch silnejší účinok a spôsobuje menej výraznú hyperinzulinémiu. Injekčné perá vo dvoch silách umožňujú využiť terapeutický efekt lixisenatidu aj pri nižších dávkach inzulínu. Výhodou lixisenatidu je aj možnosť postupnej titrácie dávky, čím sa znižuje pravdepodobnosť objavenia sa vedľajších účinkov.
Keď sa porovnávali formy intenzifikácie pacientov, ktorí boli pôvodne na PAD (štúdia Lixilan-O), fixná kombinácia lixisenatidu a bazálneho analógu glargín preukázala výhodu v porovnaní s pridaním samostatného bazálneho analógu v zmysle menšieho prírastku na hmotnosti a lepšej kompenzácie diabetu, v porovnaní s pridaním lixisenatidu zvlášť zase v menej vyjadrených gastrointestinálnych nežiaducich účinkoch a taktiež vo výraznejšom poklese HbA1c.
Pri rozdelení pacientov na podskupiny podľa hodnoty HbA1c pred liečbou (pod 8 % a nad 8 %), podľa trvania diabetu (menej, resp. vyše 6 rokov) a na základe BMI (pod 30 kg/m² a nad 30 kg/m²) sa preukázala rovnaká efektivita fixnej kombinácie oproti ostatným dvom liečebným ramenám až na podskupinu s vyšším východiskovým HbA1c, pretože títo pacienti z liečby fixnou kombináciou profitovali viac ako pacienti s nižšou východiskovou hodnotou HbA1c. Platilo to tak v zmysle poklesu hodnoty HbA1c, glykémie nalačno, ako aj hodnôt postprandiálnej glykémie.
Keď sa porovnávali pacienti, u ktorých sa popri pôvodnej liečbe bazálnym inzulínom aspoň po dobu 6 mesiacov pridal lixisenatid, s tými, ktorí zostali iba na bazálnom inzulíne (štúdia Lixilan-L), pacienti s fixnou kombináciou mali napriek lepšej kontrole diabetu menší prírastok na hmotnosti a nemali vyššie riziko hypoglykémie ako pacienti so samostatným inzulínom.
V prípade nášho pacienta išlo z pohľadu rozvoja inzulínovej rezistencie o súčasný vplyv metabolického syndrómu a dlhodobej kortikoidnej liečby. U pacienta niekoľko rokov dominoval výraznejší vplyv postprandiálnej glykémie na nedostatočnú kompenzáciu diabetu, až v poslednom roku sa zhoršila aj glykémia nalačno, preto sme stáli pred nutnosťou pridania bazálneho inzulínu. Pacient bol pôvodne zaliečený trojkombináciou PAD, čo predstavovalo podobnú východiskovú situáciu ako v prípade pacientov zaradených do štúdie Lixilan-O. Na základe zhoršujúcich sa hodnôt postprandiálnych glykémií sa však dá usúdiť, že stimulujúci účinok tak preparátov DPP-4, ako aj sulfonylurey na produkciu inzulínu pankreasom za daného stavu inzulínovej rezistencie už nebol postačujúci, preto bolo nutné pridať ďalšiu terapeutickú modalitu. Keďže lixisenatid túto možnosť pre svoju schopnosť spomedzi súčasne prístupných analógov GLP-1 výraznejšie spomaliť vyprázdňovanie žalúdka má, bolo namieste pridať ho do kombinácie s metformínom. Ďalšie podávanie sulfonylurey a preparátu DPP-4 pre podobný mechanizmus účinku už nemalo význam, preto sme ich vynechali. Pri fixnej kombinácii bazálneho inzulínového analógu glargín 100 U/ml a lixisenatidu sme dosiahli výrazne lepšiu kompenzáciu diabetu ako predtým.
Záver
Na vzniku kortikodependentného diabetu sa spolupodieľa niekoľko patofyziologických mechanizmov a jeho najtypickejšou črtou je postprandiálna hyperglykémia, čomu sa má prispôsobiť aj terapeutický prístup. Platí to obzvlášť v prípadoch, keď ide o pacienta s metabolickým syndrómom. Z pohľadu liečebných možností neexistujú štandardné odporúčania aj preto, že v prípade kortikoidov ide o veľké množstvo liečebných režimov a o prípravky s rôzne dlhým polčasom a odlišnou dynamikou ovplyvnenia metabolizmu sacharidov. Vzhľadom na to, že lixisenatid je GLP-1 analóg s dominantným a markantným účinkom na postprandiálnu glykémiu, mohol by byť v tejto podskupine pacientov adekvátnou voľbou.
Literatúra
Ako úvodná liečba bol v decembri 2014 pacientovi nasadený metformín v dávke 2 500 mg denne, pacient sa dostavil na ďalšiu kontrolu až po vyše roku vo februári 2016. Dávka prednisonu bola rovnaká, pacient však mal horšiu metabolickú kompenzáciu diabetu (glc 7,1 mmol/l, HbA1c 7,1 % DCCT, hmotnosť 92 kg). Do liečby bol pridaný linagliptín v dávke 5 mg.
Pri návšteve v septembri 2016 sme však zistili ďalšie zhoršenie metabolickej kompenzácie diabetu (glc 10,4 mmol/l, HbA1c 8,8 % DCCT, hmotnosť 92 kg). Pacientovi bolo ponúknuté pridanie bazálneho inzulínu, ktorý však odmietol, preto sme sa rozhodli pridať preparát sulfonylurey (gliklazid v dávke 60 mg) a linagliptín vymenili za kombináciu metformínu a sitagliptínu v dávke 50/1 000 mg. Pri tejto kombinácii sa podarilo pacienta udržať na hodnote HbA1c v rozmedzí 6,3 až 7,0 % s minimálnymi odchýlkami asi 1,5 roka, od marca roku 2018 sme však zaznamenali plynulý vzostup HbA1c až na hodnotu 8,1 %. Počas celého obdobia však dominovalo zhoršenie v zmysle postprandiálnej glykémie, čo potvrdili aj záznamy zo selfmonitoringu pacienta, glykémie nalačno boli v rozmedzí do 7 mmol/l, čo korešpondovalo s charakteristikami diabetu navodeného kortikoliečbou. Pacient naďalej odmietal pridanie bazálneho inzulínu, k jeho váhovému prírastku na 97 kg prispelo aj predchádzajúce navýšenie dávky gliklazidu na maximálnu dávku 120 mg.
V júli roku 2019 sme sa rozhodli pridať empagliflozín v dávke 10 mg, hodnota HbA1c sa však napriek jeho ďalšiemu navýšeniu na 25 mg naďalej udržiavala v rozmedzí 7,5 – 8,1 %, pričom hodnoty glykémií nalačno boli okolo 4,5 až 5,5 mmol/l.
Pri kontrole v marci 2020 sme zistili hodnotu HbA1c 9,2 %, vysoká však bola aj hodnota glykémie nalačno (10,2 mmol/l), pričom hodnota C-peptidu bola až 7,6 µg/l a hladina inzulínu nalačno až 25 mIU/l (HOMA index 11,2). Všetky tieto hodnoty svedčili o tom, že u pacienta sa rozvinula inzulínová rezistencia, ktorá už šla nielen na vrub predchádzajúcej kortikoidnej liečby.
Vzhľadom na to, že pacient pre inzulínovú rezistenciu a vyššiu glykémiu nalačno potreboval pridanie aspoň bazálneho inzulínu, s jeho súhlasom sme pridali bazálny inzulínový analóg glargín 300 U/ml v počiatočnej dávke 12 j., túto dávku sme podľa hodnoty rannej glykémie nalačno vytitrovali až na hodnotu 20 j. Keďže naďalej pretrvávala diskrepancia v prospech postprandiálnej glykémie, v júni 2020 sme sa rozhodli pre kombináciu glargín 100 U/ml + lixisenatid. Na úvod sme zvolili žlté pero iGlarLixi a dávku sme postupne vytitrovali na 24 j. Súčasne sme z liečby vynechali sitagliptín a aj empagliflozín. Pri poslednej kontrole v septembri 2020 sme zaznamenali hodnotu HbA1c 7,9 %, pričom postprandiálne glykémie sa darí udržiavať v rozmedzí hodnôt 8 až 11 mmol/l a hodnota C-peptidu klesla na 3,7 µg/l, čo svedčí o zlepšení inzulínovej senzitivity. Kompenzáciu DM sa darí udržiavať v prijateľnom rozmedzí napriek tomu, že pacient má zatiaľ váhavý postoj k intenzifikácii inzulínovej liečby.
Diskusia
Išlo o pacienta, u ktorého sa prejavuje kombinovaný účinok metabolického syndrómu a následnej kortikoidnej liečby na inzulínovú rezistenciu. V čase, keď po vyčerpaní možností PAD liečby u pacienta už došlo k vzostupu glykémie nalačno, sme museli pristúpiť k pridaniu bazálneho inzulínu. Keďže v prípade DM potencovaného kortikoidnou liečbou ide dominantne o vzostup postprandiálnej glykémie, hľadali sme možnosť adekvátneho prístupu, aby sme sa vyhli viacnásobnému podávaniu inzulínu pri intenzifikovaní liečby. GLP-1 analógy sú podľa najnovších odporúčaní liekom voľby u pacientov s vyšším kardiovaskulárnym rizikom. Lixisenatid patrí medzi GLP-1 analógy s krátkodobým účinkom. Pri podávaní fixnej kombinácie lixisenatidu a bazálneho inzulínového analógu sa ich účinky navzájom dopĺňajú: kým úlohou bazálneho analógu je tlmenie hepatálnej produkcie glukózy, lixisenatid popri známych efektoch ostatných GLP-1 analógov znižuje výrazne postprandiálnu glykémiu aj spomalením vyprázdňovania žalúdka, čím sa líši od GLP-1 analógov s pomalým účinkom. Napriek tomu, že jeho efekt na pokles glykémií nalačno je menej výrazný ako v prípade dlho účinkujúcich GLP-1 analógov, na postprandiálny vzostup glykémie má popri prandiálnych inzulínových analógoch silnejší účinok a spôsobuje menej výraznú hyperinzulinémiu. Injekčné perá vo dvoch silách umožňujú využiť terapeutický efekt lixisenatidu aj pri nižších dávkach inzulínu. Výhodou lixisenatidu je aj možnosť postupnej titrácie dávky, čím sa znižuje pravdepodobnosť objavenia sa vedľajších účinkov.
Keď sa porovnávali formy intenzifikácie pacientov, ktorí boli pôvodne na PAD (štúdia Lixilan-O), fixná kombinácia lixisenatidu a bazálneho analógu glargín preukázala výhodu v porovnaní s pridaním samostatného bazálneho analógu v zmysle menšieho prírastku na hmotnosti a lepšej kompenzácie diabetu, v porovnaní s pridaním lixisenatidu zvlášť zase v menej vyjadrených gastrointestinálnych nežiaducich účinkoch a taktiež vo výraznejšom poklese HbA1c.
Pri rozdelení pacientov na podskupiny podľa hodnoty HbA1c pred liečbou (pod 8 % a nad 8 %), podľa trvania diabetu (menej, resp. vyše 6 rokov) a na základe BMI (pod 30 kg/m² a nad 30 kg/m²) sa preukázala rovnaká efektivita fixnej kombinácie oproti ostatným dvom liečebným ramenám až na podskupinu s vyšším východiskovým HbA1c, pretože títo pacienti z liečby fixnou kombináciou profitovali viac ako pacienti s nižšou východiskovou hodnotou HbA1c. Platilo to tak v zmysle poklesu hodnoty HbA1c, glykémie nalačno, ako aj hodnôt postprandiálnej glykémie.
Keď sa porovnávali pacienti, u ktorých sa popri pôvodnej liečbe bazálnym inzulínom aspoň po dobu 6 mesiacov pridal lixisenatid, s tými, ktorí zostali iba na bazálnom inzulíne (štúdia Lixilan-L), pacienti s fixnou kombináciou mali napriek lepšej kontrole diabetu menší prírastok na hmotnosti a nemali vyššie riziko hypoglykémie ako pacienti so samostatným inzulínom.
V prípade nášho pacienta išlo z pohľadu rozvoja inzulínovej rezistencie o súčasný vplyv metabolického syndrómu a dlhodobej kortikoidnej liečby. U pacienta niekoľko rokov dominoval výraznejší vplyv postprandiálnej glykémie na nedostatočnú kompenzáciu diabetu, až v poslednom roku sa zhoršila aj glykémia nalačno, preto sme stáli pred nutnosťou pridania bazálneho inzulínu. Pacient bol pôvodne zaliečený trojkombináciou PAD, čo predstavovalo podobnú východiskovú situáciu ako v prípade pacientov zaradených do štúdie Lixilan-O. Na základe zhoršujúcich sa hodnôt postprandiálnych glykémií sa však dá usúdiť, že stimulujúci účinok tak preparátov DPP-4, ako aj sulfonylurey na produkciu inzulínu pankreasom za daného stavu inzulínovej rezistencie už nebol postačujúci, preto bolo nutné pridať ďalšiu terapeutickú modalitu. Keďže lixisenatid túto možnosť pre svoju schopnosť spomedzi súčasne prístupných analógov GLP-1 výraznejšie spomaliť vyprázdňovanie žalúdka má, bolo namieste pridať ho do kombinácie s metformínom. Ďalšie podávanie sulfonylurey a preparátu DPP-4 pre podobný mechanizmus účinku už nemalo význam, preto sme ich vynechali. Pri fixnej kombinácii bazálneho inzulínového analógu glargín 100 U/ml a lixisenatidu sme dosiahli výrazne lepšiu kompenzáciu diabetu ako predtým.
Záver
Na vzniku kortikodependentného diabetu sa spolupodieľa niekoľko patofyziologických mechanizmov a jeho najtypickejšou črtou je postprandiálna hyperglykémia, čomu sa má prispôsobiť aj terapeutický prístup. Platí to obzvlášť v prípadoch, keď ide o pacienta s metabolickým syndrómom. Z pohľadu liečebných možností neexistujú štandardné odporúčania aj preto, že v prípade kortikoidov ide o veľké množstvo liečebných režimov a o prípravky s rôzne dlhým polčasom a odlišnou dynamikou ovplyvnenia metabolizmu sacharidov. Vzhľadom na to, že lixisenatid je GLP-1 analóg s dominantným a markantným účinkom na postprandiálnu glykémiu, mohol by byť v tejto podskupine pacientov adekvátnou voľbou.
Literatúra
- Julio Rosenstock, Ronnie Aronson, George Grunberger, et. al. Benefits of LixiLan, a Titratable Fixed-Ratio Combination of Insulin Glargine Plus Lixisenatide, Versus Insulin Glargine and Lixisenatide Monocomponents in Type 2 Diabetes Inadequately Controlled on Oral Agents: The LixiLan-O Randomized Trial. Diabetes Care 2016 Nov; 39(11): 2026-2035.
- Aroda VR, Rosenstock J, Wysham C et al. Efficacy and Safety of LixiLan, a Titratable Fixed-Ratio Combination of Insulin Glargine Plus Lixisenatide in Type 2 Diabetes Inadequately Controlled on Basal Insulin and metformin: The LixiLan-L Randomized Trial. Diabetes Care 2016 Nov; 39(11): 1972-1980.
- Davies MJ, Leiter LA, Guerci B et al. Impact of baseline glycated haemoglobin, diabetes duration and body mass index on clinical outcomes in the LixiLan-O trial testing a titratable fixed-ratio combination of insulin glargine/lixisenatide (iGlarLixi) vs insulin glargine and lixisenatide monocomponents. Diabetes Obes Metab 2017 Dec; 19(12): 1798–1804.
- Raalte DH , Diamant M. Steroid diabetes: from mechanism to treatment? Neth J Med 2014 Feb; 72 (2):62-72.
- Hwang JL , Weiss Roy E. Steroid-induced diabetes: a clinical and molecular approach to understanding and treatment. Diabetes Metab Res Rev. 2014 Feb;30(2):96-102.
- Steroid-induced diabetes: is it just unmasking of type 2 diabetes? Simmons LR, Molyneaux L, Yue DK et al. ISRN Endocrinol , 2012;2012:910905. doi: 10.5402/2012/910905. Epub 2012 Jul 5
- Treating steroid-induced diabetes. Tracy Tylee, MD, University of Washington – 4th Dec 2018. www.medmastery.com


