Riziko kardiovaskulárních komplikací v závislosti na hladině glykemie: od diabetes mellitus k prediabetu
Michael Jenšovský,1 Jana Malinovská,1 Ludmila Brunerová,2 Veronika Vejtasová,3 Rhea Saldanha,1 Kristýna Kučera,4 Jan Brož1
1Interní klinika 2. LF UK a FN Motol, Praha 2Diabetologické centrum II. interní kliniky 3. LF UK a FN Královské Vinohrady, Praha 3Kardiologická klinika 2. LF UK a FN Motol 4Arbeitsgemeinschaft der Belegärzte am Alice-Hospital, Darmstadt, Germany
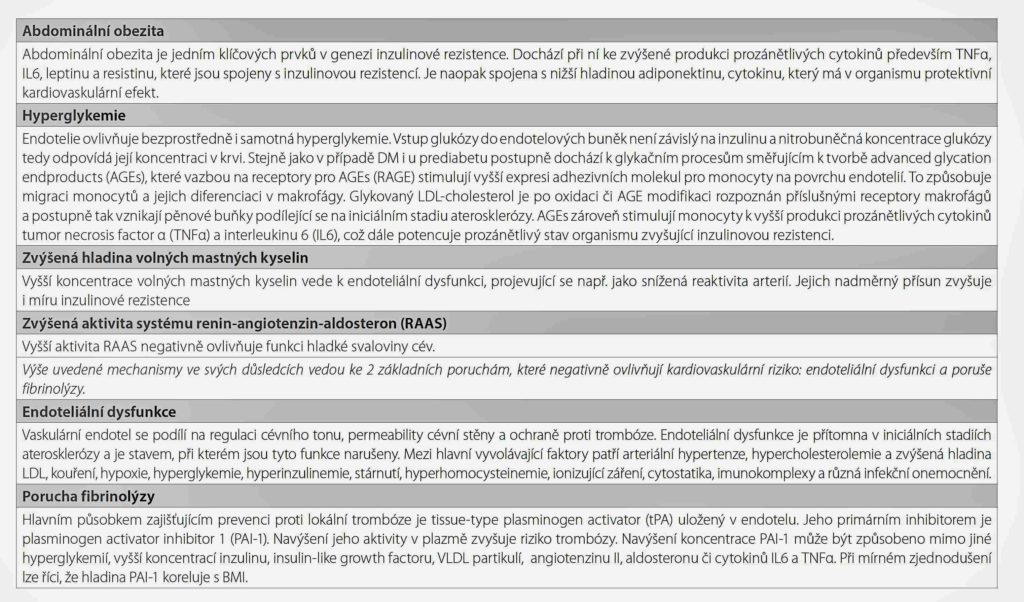
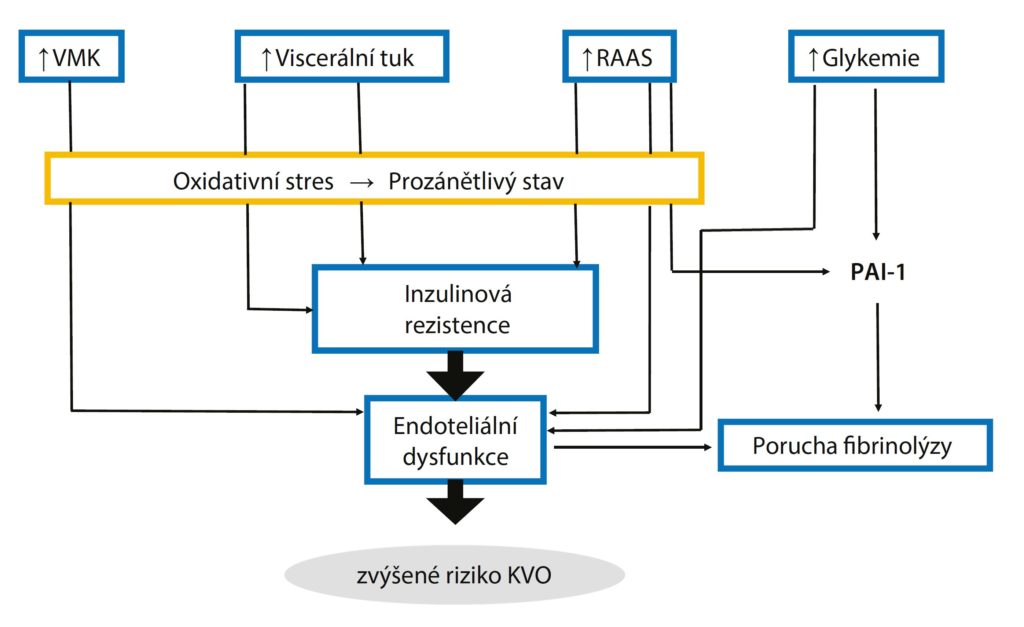
Diabetes mellitus (DM) je známý rizikový faktor kardiovaskulárních onemocnění (KVO) včetně ischemické choroby srdeční (ICHS) a 2-násobně zvyšuje riziko smrti z kardiovaskulárních příčin. Podle aktuálních znalostí se pravděpodobnost výskytu ICHS zvyšuje s rostoucí hladinou glykemie nalačno v rámci prediabetického rozmezí. V pásmu glykemií 5,6–6,0 mmol/l je riziko ICHS 1,11,v rozmezí 6,1–6,9 mmol/l je toto riziko 1,17. V rozmezí hodnot HbA1c 42–47 mmol/mol je riziko ICHS 1,28. Pravděpodobnost přítomnosti ICHS tedy s narůstající glykemií v rámci prediabetických hodnot stoupá, tato závislost však není lineární. Klíčová slova: diabetes mellitus, glykemie, kardiovaskulární onemocnění, prediabetes. Diabetes is an established risk factor of cardiovascular disease including the coronary heart disease (CHD) and elevates the risk of cardiovascular death 2-times. Based on current evidence the risk of acquiring the CHD increases accordingly to the level of fasting blood glucose even in the prediabetic range. In the range of 5.6–6.0 mmol/l the risk is 1.11, in the range of 6.1–6.9 mmol/l the risk is 1.17. In the range of HbA1c of 42–47 mmol/l the risk of the CHD is 1.28. The probability of the CHD occurrence therefore does indeed increase in conjunction with the fasting blood glucose levels but the dependence is not linear. Key words: blood glucose concentration, cardiovascular disease, diabetes mellitus, prediabetes. Úvod Souvislost mezi diabetem a kardiovaskulárním onemocněním (KVO) byla zkoumána po téměř celé 20. století.1,2 Průlomovou prací v tomto ohledu byla studie z roku 1979 vycházející z dat Framingham Heart Study (FHS), jež zařadila diabetes mezi rizikové faktory KVO.3 Podle některých odhadů bude v roce 2035 celosvětově diabetes mellitus (DM) trpět 592 milionů lidí,4 což představuje významný nárůst oproti stavu přibližně 422 milionů nemocných v roce 2014 a ještě podstatnější změnu oproti době výsledků FHS s celkovým počtem nemocných dosahujícím 108 milionů v roce 1980. Nárůst je patrný nejen v absolutních číslech, ale i v prevalenci (4,7 % v roce 1980 vs. 8,5 % v roce 2014).5 Detailnější pohled na kvantifikaci kardiovaskulárních mortalitních rizik ve vztahu k DM přinesla např. průřezová studie na finské populaci z roku 1998, která srovnávala podskupinu pacientů s DM 2. typu (DM2T) bez předchozího infarktu myokardu (IM) a podskupinu bez DM s předchozím IM. U obou zjistila podobně zvýšené riziko IM.6 Potvrzena tak byla teorie, že DM představuje s ohledem na IM obdobné kardiovaskulární riziko jako již preexistující ICHS.7 Oblastí zájmu se stala i analýza kardiovaskulární mortality s rozdělením na podskupiny podle jedné konkrétní diagnózy DM, IM nebo cévní mozková příhoda (CMP) i dle všech jejich kombinací. Ve skupinách pacientů s kombinacemi těchto diagnóz roste mortalita násobně. Skupina pouze s DM měla riziko mortality z jakékoliv příčiny přibližně 2-krát vyšší, při kombinaci dvou z výše uvedených diagnóz 4-krát vyšší a při kombinaci všech zkoumaných diagnóz vzrostlo riziko 8-krát.8,9 Na druhé straně oproti jasně zvýšenému riziku KVO u DM byl zaznamenán i trend snižování jejich incidence, spojený zřejmě s pokrokem diagnostických a preventivně-terapeutických možností. Prezentovala ho studie z roku 2014 zabývající se vývojem komplikací DM v letech 1990–2010 u americké populace, jež prokázala redukci v incidenci AIM a CMP.10 Klesající tendenci vykazuje u DM jak celková mortalita, tak i mortalita z kardiovaskulárních příčin. Mezi roky 1998–2014 klesla na vzorku švédské populace celková mortalita u pacientů s diabetem 1. typu o 29%, u diabetu 2. typu o 21 %, kardiovaskulární mortalita klesla u diabetu 1. typu o 42 % a u diabetu 2. typu o 46 %. Přesto zůstává celková mortalita vyšší než u kontrolní skupiny zdravých a u diabetu 2. typu klesá pomaleji než u této kontrolní skupiny.11 Obdobný pokles byl prokázán i u české populace. U pacientů s DM užívajících perorální antidiabetika se celková mortalita snižovala rychleji než v běžné populaci ve všech zkoumaných věkových skupinách.12 Další logickou otázkou, na kterou se nyní hledá odpověď, je, zdali kardiovaskulární riziko zvyšuje i prediabetes. Prediabetes Prediabetes v sobě tradičně zahrnuje 2 jednotky: porušenou glukózovou toleranci (PGT) a hraniční glykemii na lačno (HGL). Porušená glukózová tolerance je definována dosažením hodnoty v rozmezí 7,8–11 mmol/l ve 120. min orálního glukózového testu. HGL je definována různými způsoby: podle americké diabetologické asociace (American Diabetes Association – ADA) jde o glykemii na lačno v pásmu 5,6–6,9 mmol/l, dle Světové zdravotnické organizace (World Health Organization – WHO) se jedná o pásmo 6,1–6,9 mmol/l. Česká diabetologická společnost (ČDS) definuje HGL shodně s ADA.13 Další, novější, definice prediabetu podle ADA je vytvořena na základě hodnot glykovaného hemoglobinu (HbA1c), a to v rozmezí 39–47 mmol/mol, tuto definici jako pomocnou využívá i ČDS.14 Méně přísná kritéria v rozpětí 42–47 mmol/mol byla navržena a prezentována v tzv. guidance od National Instutute for Health and Care Excellence (NICE).15 Testování na základě hodnot HbA1c zachytí podstatně menší a tedy z hlediska glukózové dysregulace i odlišnou skupinu prediabetiků než v případě, že je využita lačná glykemie a oGTT.16 To se odráží i ve výsledcích intervenčních studií, jak uvidíme dále. Prediabetes je, jak název napovídá, předstupněm diabetu a u přibližně 70 % pacientů s prediabetem se posléze diabetes opravdu rozvine.17 Rychlost této změny je různá a souvisí s individuálními charakteristikami pacientů (především rychlostmi nárůstu hmotnosti a poklesu sekrece inzulinu), nejdelší časová vzdálenost mezi prvním záchytem prediabetu a průkazem diabetu byla v jedné ze studií 13 let.18 Prediabetes je spojen s rozvojem nejen makrovaskulárních, ale i specifických mikrovaskulárních komplikací diabetu.14 Podle prospektivních odhadů vytvořených Mezinárodní diabetologickou federací (International Diabetes Federation – IDF) stoupne globální prevalence prediabetu v populaci 20–79 let ze 7,3 % (352 milionů) postižených v roce 2017 na 8,3 % (587 milionů) v roce 2045. Prevalence prediabetu se liší etnicky i kontinentálně a subkontinentálně, nejvyšší je v severní Americe (15,4 % v roce 2017).19 V České republice je podle výsledků studie Evropský průzkum zdravotního stavu populace (European Health Examination Survey – EHES) z roku 2014 v populaci ve věku mezi 25 a 64 let 26,6 % pacientů s prediabetem mezi muži a 25,2 % mezi ženami.20,21 Ve věkové skupině 55–64 to bylo 45 % u mužů a 37 % u žen.22 Zvýšení kardiovaskulárního rizika Zvýšené kardiovaskulární riziko je výsledkem především dvou patofyziologických změn týkajících se krevního řečiště a to endoteliální dysfunkce a poruchy fybrinolýzy. Detailní popis mechanismů, které vedou k těmto změnám, překračuje intence tohoto článku, proto v rámečku (příloha 1) uvádíme jen jejich základní shrnutí.23 Principiální vztahy těchto procesů jsou schematicky znázorněny na Obr. 1.Příloha 1.: Rámcový pohled na patofyziologické procesy zvyšující kardiovaskulární riziko u pacientů s prediabetem23
 Počátek snah ověřit spojení prediabetu s KVO lze najít už ve studiích z 90. let minulého století, kdy proběhla finská studie zabývající se mortalitou u starších mužů, ve které byla sledována i podskupina pacientů s PGT. V této selektované části populace se prokázala vyšší celková mortalita (Odds Ratio – OR 1,17) i kardiovaskulární mortalita (OR 1,13), která byla nejčastější příčinou úmrtí.24
Počátek snah ověřit spojení prediabetu s KVO lze najít už ve studiích z 90. let minulého století, kdy proběhla finská studie zabývající se mortalitou u starších mužů, ve které byla sledována i podskupina pacientů s PGT. V této selektované části populace se prokázala vyšší celková mortalita (Odds Ratio – OR 1,17) i kardiovaskulární mortalita (OR 1,13), která byla nejčastější příčinou úmrtí.24
Obr. 1.: Schematické znázornění mechanismů zodpovědných za zvýšené kardiovaskulární riziko u pacientů s prediabetem. Adaptováno dle (23)
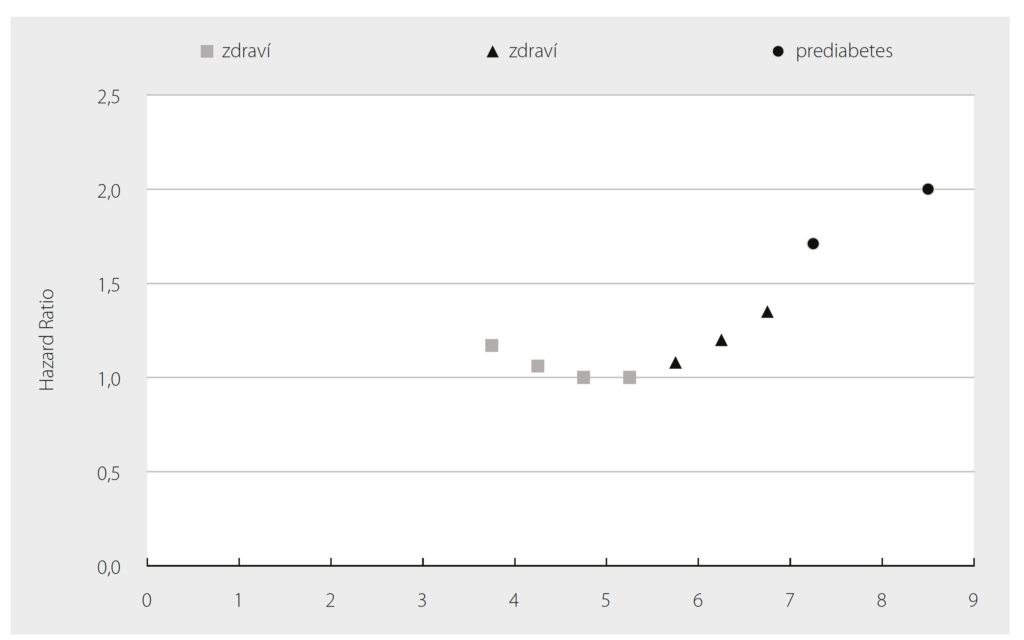
 Asi nejpodrobnější aktuální odpověď však přináší metaanalýza 102 prospektivních studií z roku 2010,25 jež se zabývala vlivem hladiny glykemie nalačno na riziko ICHS a CMP. Díky vysokému počtu analyzovaných studií dosáhl počet subjektů zařazených do analýzy čísla 698 782 s 52 765 fatálními i nefatálními vaskulárními příhodami. Pro zahrnutí do metaanalýzy musela studie splnit následující kritéria: pacienti nesměli být selektováni na základě historie KVO, byla zaznamenána příčina smrti anebo přítomnost vaskulárního onemocnění a sledování účastníků trvalo nejméně 1 rok. Průměrný věk účastníků byl 52 let (směrodatná odchylka – SD 13), celkem 96 % jich pocházelo z Evropy, Severní Ameriky nebo Australasie a ženy tvořily 43 %. Výsledky studie nebyly překvapivé v případě diabetu, kdy se potvrdilo zvýšení rizika úmrtí na dvojnásobek u diabetiků ve srovnání se skupinou bez této diagnózy. Jedním z hlavních cílů však bylo určit závislost rizika úmrtí (Hazard Ratio – HR) na glykemii na lačno a to včetně hodnot nižších než 7 mmol/l. Pacienti s diabetem byli rozděleni na 2 skupiny a pacienti bez známé diagnózy diabetu byli rozděleni do 5 skupin dle hladin glykemie na lačno. Analýza prokázala zvýšení rizika ICHS u pacientů s prediabetem. Ve srovnání s normoglykemickou skupinou stoupá HR pro ICHS na 1,11 při glykemii na lačno 5,6–6,1 mmol/l a na 1,17 při 6,1–7,0 mmol/l (Graf 1). Riziko ICHS se pro hladinu glykemie zvyšuje nelineárně. Autoři upozorňují na určitý rozpor oproti starším pracím, ve kterých se předpokládala lineární závislost pro hladiny glykemie na lačno, a tedy, že riziko KVO bude u pacientů s hodnotou glykemie v rozmezí prediabetu podstatně vyšší. Příkladem mohou být guidelines European Society of Cardiology (ESC) pro diabetes, prediabetes a KVO z roku 2007, které vychází z některých starších studií a prediabetu přikládají větší význam v predikci kardiovaskulární mortality a předpokládají její kontinuální závislost na hladině glykemie na lačno. Nicméně už v guidelines samotných se uvádí, že dostupná data nejsou v tomto směru dostatečně průkazná.26 Zajímavým zjištěním je mírné zvýšení rizika výskytu ICHS i u těch zdravých osob, jejichž glykemie na lačno se přibližuje či klesá pod 4 mmol/l (za normu jsou považovány hodnoty > 3,5 a < 5,6 mmol/l). Tato asociace nebyla dosud předmětem výzkumu, prokázán byl zatím jen negativní vliv hypoglykemie na KVO při léčbě DM (hypoglykemie je u diabetu definována hodnotami < 4 mmol/l).27
Asi nejpodrobnější aktuální odpověď však přináší metaanalýza 102 prospektivních studií z roku 2010,25 jež se zabývala vlivem hladiny glykemie nalačno na riziko ICHS a CMP. Díky vysokému počtu analyzovaných studií dosáhl počet subjektů zařazených do analýzy čísla 698 782 s 52 765 fatálními i nefatálními vaskulárními příhodami. Pro zahrnutí do metaanalýzy musela studie splnit následující kritéria: pacienti nesměli být selektováni na základě historie KVO, byla zaznamenána příčina smrti anebo přítomnost vaskulárního onemocnění a sledování účastníků trvalo nejméně 1 rok. Průměrný věk účastníků byl 52 let (směrodatná odchylka – SD 13), celkem 96 % jich pocházelo z Evropy, Severní Ameriky nebo Australasie a ženy tvořily 43 %. Výsledky studie nebyly překvapivé v případě diabetu, kdy se potvrdilo zvýšení rizika úmrtí na dvojnásobek u diabetiků ve srovnání se skupinou bez této diagnózy. Jedním z hlavních cílů však bylo určit závislost rizika úmrtí (Hazard Ratio – HR) na glykemii na lačno a to včetně hodnot nižších než 7 mmol/l. Pacienti s diabetem byli rozděleni na 2 skupiny a pacienti bez známé diagnózy diabetu byli rozděleni do 5 skupin dle hladin glykemie na lačno. Analýza prokázala zvýšení rizika ICHS u pacientů s prediabetem. Ve srovnání s normoglykemickou skupinou stoupá HR pro ICHS na 1,11 při glykemii na lačno 5,6–6,1 mmol/l a na 1,17 při 6,1–7,0 mmol/l (Graf 1). Riziko ICHS se pro hladinu glykemie zvyšuje nelineárně. Autoři upozorňují na určitý rozpor oproti starším pracím, ve kterých se předpokládala lineární závislost pro hladiny glykemie na lačno, a tedy, že riziko KVO bude u pacientů s hodnotou glykemie v rozmezí prediabetu podstatně vyšší. Příkladem mohou být guidelines European Society of Cardiology (ESC) pro diabetes, prediabetes a KVO z roku 2007, které vychází z některých starších studií a prediabetu přikládají větší význam v predikci kardiovaskulární mortality a předpokládají její kontinuální závislost na hladině glykemie na lačno. Nicméně už v guidelines samotných se uvádí, že dostupná data nejsou v tomto směru dostatečně průkazná.26 Zajímavým zjištěním je mírné zvýšení rizika výskytu ICHS i u těch zdravých osob, jejichž glykemie na lačno se přibližuje či klesá pod 4 mmol/l (za normu jsou považovány hodnoty > 3,5 a < 5,6 mmol/l). Tato asociace nebyla dosud předmětem výzkumu, prokázán byl zatím jen negativní vliv hypoglykemie na KVO při léčbě DM (hypoglykemie je u diabetu definována hodnotami < 4 mmol/l).27
Graf 1.: Schematické znázornění závislosti HR KVO na hodnotách glykemie na lačno. Adaptováno podle (25)
 Výsledky nověji doplnila i metaanalýza čínských autorů z roku 2016, která měla výhodu ještě větší zkoumané skupiny čítající 1 611 339 účastníků. Zahrnuto bylo 53 prospektivních studií a z výběru byly vyloučeny práce, které pacienty selektovaly na základě jejich předchozích kardiovaskulárních onemocnění. Na rozdíl od studie z roku 2010 zde nebyla sledována hladina glykemie na lačno jako taková, ale byly porovnávány skupiny splňující definici prediabetu dle WHO a ADA, přičemž HGL a PGT byly hodnoceny zvlášť a srovnány s normoglykemickou skupinou. Navíc byla srovnávána i skupina prediabetu definovaná podle hodnot HbA1c. S ohledem na dříve zmíněná 2 definiční pásma autoři použili obě diagnostická rozmezí zvlášť. Hodnocen byl vliv na celkovou mortalitu, ICHS a CMP a samostatně definovanou skupinu KVO (DFKVO). HGL, ať už dle definice ADA, nebo WHO, byla asociována se signifikantně vyšším rizikem celkové mortality s relativním rizikem (relative risk – RR) 1,13 (95% interval spolehlivosti – CI, Confidence Interval 1,02–1,25), resp. 1,13 (95% CI 1,02–1,21). Riziko úmrtí bylo výrazně vyšší v případě PGT, kdy RR dosahovalo 1,32 (95% CI 1,23–1,40). U hladin glykovaného hemoglobinu se neprokázalo signifikantně zvýšené riziko celkové mortality, ať už se jednalo o pásmo 39–47 mmol/mol (0,97; CI 0,88–1,07), nebo 42– 47 mmol/mol (1,21; CI 0,95–1,56).
Negativní efekt ve smyslu zvýšení RR DFKVO byl prokázán u všech sledovaných skupin prediabetu bez ohledu na definici. Pro HGL dle ADA bylo RR 1,13 (95% CI 1,05–1,21), dle WHO 1,26 (CI 1,12–1,41), pro PGT 1,30 (CI 1,19–1,42). Pro mírně odlišná pásma hladin glykovaného hemoglobinu 38,8–46,4 mmol/mol bylo RR 1,21 (CI 1,01–1,44) a 42,11–46,4 mmol/mol bylo RR 1,25 (CI 1,01–1,55). Výsledky vlivu prediabetu na ICHS byly podobné jako u předchozího porovnání, přičemž se opět prokázala asociace u všech zkoumaných skupin. Konkrétně se jedná o RR 1,10 (95% CI 1,04–1,16) pro HGL-ADA, 1,18 (CI 1,08–1,28) pro HGL-WHO, 1,20 (CI 1,0–1,44) pro PGT, 1,15 (CI 1,01–1,33) pro HbA1c 39–47 mmol/mol a 1,28 (CI 1,03–1,59) pro HbA1c 42–47 mmol/mol.
Analýza vlivu prediabetu definovaného podle HbA1c na incidenci CMP neukázala její vyšší riziko. U prediabetiků definovaných podle ostatních kritérií bylo riziko CMP mírně zvýšené: HGL-ADA RR 1,06 (95% CI 1,01–1,11), HGL-WHO 1,17 (CI 1,09–1,25) a PGT 1,05 (CI 0,81–1,35).28 Závažnost postižení koronárních tepen aterosklerózou je vyšší u pacientů s akutním koronárním syndromem a DM nebo prediabetem diagnostikovaných dle HbA1c. Ve srovnání s euglykemickými pacienty u nich byly zaznamenány vyšší hodnoty SYNTAX a Gensini skóre, které slouží k posouzení komplexity lézí a častější než u kontrolní skupiny byla také nemoc 3 tepen. Hodnoty těchto skórovacích systémů byly podobné u pacientů s DM i pacientů s prediabetem, rozdíl nebyl statisticky významný, stejně jako rozdíl ve výskytu nemoci 3 tepen.29
Poznámky k možnostem terapie
Společně s daty o vyšším riziku KVO u prediabetiků vyvstává otázka, zda můžeme toto riziko snížit pomocí adekvátní
a úspěšné terapie. Částečnou odpověď přináší analýza dat ze studie Whitehall II a také dlouhodobé sledování pacientů z Da Qing Diabetes Prevention Outcome Study.30,31 U pacientů ze studie Whitehall II byla po reverzi do normoglykemie pozorována souhrnná redukce rizika úmrtí z jakékoliv příčiny a rizika rozvoje KVO o přibližně 50 % u pacientů s PGT. U pacientů s prediabetem diagnostikovaným pomocí ostatních kritérií se naopak takovýto efekt po 5 letém sledování neprokázal. Prediabetes byl diagnostikovaný na základě oGTT i v Da Qing Diabetes Prevention Outcome Study započaté roku 1986, v níž je většina pacientů sledována doposud. Pomocí úpravy životního stylu (fyzická aktivita, dietní opatření nebo jejich kombinace) bylo dosaženo snížení incidence kardiovaskulárních příhod (HR 0,74). Snížen byl výskyt úmrtí z kardiovaskulárních příčin (HR 0,67) i úmrtí celkových (HR 0,74). Prokázán byl i další benefit úpravy životního stylu, a to oddálení nástupu DM v průměru o 4 roky.
Nefarmakologická léčba pomocí úpravy životního stylu je tedy účinná v prevenci progrese PGT do DM a redukci rizika KVO a je základem terapie. Při vědomí výše uvedených patofyziolgických procesů je zjevné, že část medikamentózních i nemedikamentózních terapeutických zásahů, které uvádíme v textu, mají svůj potenciál nejen v „makroskopických“ ukazatelích, jakými jsou např. glykemie, HbA1c, hladiny lipidů, hodnoty krevního tlaku, ale projeví se přímo či nepřímo i na „mikroskopické“ úrovni v podobě zlepšení endoteliální dysfunkce a fibrinolytických schopností endotelu.13,32,23
Soubor opatření by měl zahrnovat zanechání kouření i vyvarování se pasivní expozici, úpravu stravovacích zvyklostí a provozování fyzické aktivity v rámci obvyklých doporučení. U pacientů s nadváhou nebo obezitou by cílem měla být redukce váhy. Dietní opatření závisí na současných návycích pacienta, obecně je doporučeno snížit kalorický příjem a preferována je středomořská strava. Konzumace kávy a čaje ani ve zvýšeném množství nezvyšuje pravděpodobnost KVO ani DM, ale naopak jejich výskyt zřejmě snižuje. Suplementace vitaminů a mikronutrientů s cílem snížit výskyt KVO a DM není doporučena. Fyzická aktivita by měla zahrnovat aerobní i odporový trénink a trvat by měla minimálně 150 min týdně, možným schématem je např. 30 min 5-krát týdně. Výhodou nefarmakologické terapie je její účinek nejen na samotný prediabetes, ale také na případné komorbidity, které nezávisle zvyšují riziko kardiovaskulárních příhod, a to zejména na hypertenzi a dyslipidemii.
Farmakoterapie u prediabetu je stále se vyvíjející problematikou a zatím chybí důkazy stran redukce kardiovaskulárního rizika. Metformin může být zvážen za účelem prevence progrese do DM zejména u rizikových pacientů, tzn. s BMI ≥ 35 kg/m2, historií gestačního diabetes mellitus, mladších 60 let či s dalšími rizikovými faktory. Účinnost tohoto postupu se v různých studiích liší. U pacientů v Diabetes Prevention Program byl méně účinný než úprava životního stylu, v čase se však rozdíly zmenšovaly. U vybraných skupin pacientů s rizikovými faktory v téže studii byl naopak účinek na podobné úrovni jako nefarmakologická terapie prokázán. V současnosti zůstává prediabetes off-label indikací metforminu.33,34 Zkoumány byly i kombinace metforminu s pioglitazonem a trojkombinace s agonistou GLP-1R, které snížily riziko progrese do DM u rizikových pacientů (HR 0,29, resp. 0,12). Dlouhodobé účinky léčby metforminem na KVO jsou v současnosti předmětem testování, nicméně výsledky nelze očekávat dříve než v roce 2024 (VA-IMPACT, GLINT).
Kromě samotného prediabetu je nutné vyhledávat a léčit komorbidity, jako je arteriální hypertenze a dyslipidemie. Ve farmakoterapii arteriální hypertenze by měly být preferovány inhibitory renin-angio-tenzin-aldosteronového systému před betablokátory (BB) a diuretiky. Kombinace BB a diuretika zvyšuje riziko progrese prediabetu do DM, zatímco valsartan toto riziko snižuje a ramirpil podporuje reverzi do normoglykemie. Cílové hodnoty systolického krevního tlaku by neměly přesahovat 130 mmHg, další snižování zřejmě nepřináší celkový benefit, ale dle některých studií snižuje incidenci CMP. Léčba dyslipidemie je zásadní, ale v současnosti není doporučena modifikace postupu u pacientů s prediabetem.32
Závěr
Podle aktuálních znalostí se pravděpodobnost výskytu ICHS zvyšuje s rostoucí hladinou glykemie na lačno i v rámci prediabetického rozmezí. V pásmu glykemií 5,6–6,0 mmol/l je riziko ICHS 1,11, v rozmezí 6,1–6,9 mmol/l je toto riziko 1,17. Díváme-li se na prediabetes prizmatem HbA1c, pak je riziko ICHS 1,28 v rozmezí hodnot HbA1c 42–47 mmol/mol. Pravděpodobnost přítomnosti ICHS tedy s narůstající glykemií stoupá, tato závislost však není lineární a byla prokázána pro prediabetes definovaný podle všech používaných diagnostických kritérií. Tyto výsledky jsou dalším faktorem ukazujícím na význam screeningu prediabetu v populaci.
Literatura
Výsledky nověji doplnila i metaanalýza čínských autorů z roku 2016, která měla výhodu ještě větší zkoumané skupiny čítající 1 611 339 účastníků. Zahrnuto bylo 53 prospektivních studií a z výběru byly vyloučeny práce, které pacienty selektovaly na základě jejich předchozích kardiovaskulárních onemocnění. Na rozdíl od studie z roku 2010 zde nebyla sledována hladina glykemie na lačno jako taková, ale byly porovnávány skupiny splňující definici prediabetu dle WHO a ADA, přičemž HGL a PGT byly hodnoceny zvlášť a srovnány s normoglykemickou skupinou. Navíc byla srovnávána i skupina prediabetu definovaná podle hodnot HbA1c. S ohledem na dříve zmíněná 2 definiční pásma autoři použili obě diagnostická rozmezí zvlášť. Hodnocen byl vliv na celkovou mortalitu, ICHS a CMP a samostatně definovanou skupinu KVO (DFKVO). HGL, ať už dle definice ADA, nebo WHO, byla asociována se signifikantně vyšším rizikem celkové mortality s relativním rizikem (relative risk – RR) 1,13 (95% interval spolehlivosti – CI, Confidence Interval 1,02–1,25), resp. 1,13 (95% CI 1,02–1,21). Riziko úmrtí bylo výrazně vyšší v případě PGT, kdy RR dosahovalo 1,32 (95% CI 1,23–1,40). U hladin glykovaného hemoglobinu se neprokázalo signifikantně zvýšené riziko celkové mortality, ať už se jednalo o pásmo 39–47 mmol/mol (0,97; CI 0,88–1,07), nebo 42– 47 mmol/mol (1,21; CI 0,95–1,56).
Negativní efekt ve smyslu zvýšení RR DFKVO byl prokázán u všech sledovaných skupin prediabetu bez ohledu na definici. Pro HGL dle ADA bylo RR 1,13 (95% CI 1,05–1,21), dle WHO 1,26 (CI 1,12–1,41), pro PGT 1,30 (CI 1,19–1,42). Pro mírně odlišná pásma hladin glykovaného hemoglobinu 38,8–46,4 mmol/mol bylo RR 1,21 (CI 1,01–1,44) a 42,11–46,4 mmol/mol bylo RR 1,25 (CI 1,01–1,55). Výsledky vlivu prediabetu na ICHS byly podobné jako u předchozího porovnání, přičemž se opět prokázala asociace u všech zkoumaných skupin. Konkrétně se jedná o RR 1,10 (95% CI 1,04–1,16) pro HGL-ADA, 1,18 (CI 1,08–1,28) pro HGL-WHO, 1,20 (CI 1,0–1,44) pro PGT, 1,15 (CI 1,01–1,33) pro HbA1c 39–47 mmol/mol a 1,28 (CI 1,03–1,59) pro HbA1c 42–47 mmol/mol.
Analýza vlivu prediabetu definovaného podle HbA1c na incidenci CMP neukázala její vyšší riziko. U prediabetiků definovaných podle ostatních kritérií bylo riziko CMP mírně zvýšené: HGL-ADA RR 1,06 (95% CI 1,01–1,11), HGL-WHO 1,17 (CI 1,09–1,25) a PGT 1,05 (CI 0,81–1,35).28 Závažnost postižení koronárních tepen aterosklerózou je vyšší u pacientů s akutním koronárním syndromem a DM nebo prediabetem diagnostikovaných dle HbA1c. Ve srovnání s euglykemickými pacienty u nich byly zaznamenány vyšší hodnoty SYNTAX a Gensini skóre, které slouží k posouzení komplexity lézí a častější než u kontrolní skupiny byla také nemoc 3 tepen. Hodnoty těchto skórovacích systémů byly podobné u pacientů s DM i pacientů s prediabetem, rozdíl nebyl statisticky významný, stejně jako rozdíl ve výskytu nemoci 3 tepen.29
Poznámky k možnostem terapie
Společně s daty o vyšším riziku KVO u prediabetiků vyvstává otázka, zda můžeme toto riziko snížit pomocí adekvátní
a úspěšné terapie. Částečnou odpověď přináší analýza dat ze studie Whitehall II a také dlouhodobé sledování pacientů z Da Qing Diabetes Prevention Outcome Study.30,31 U pacientů ze studie Whitehall II byla po reverzi do normoglykemie pozorována souhrnná redukce rizika úmrtí z jakékoliv příčiny a rizika rozvoje KVO o přibližně 50 % u pacientů s PGT. U pacientů s prediabetem diagnostikovaným pomocí ostatních kritérií se naopak takovýto efekt po 5 letém sledování neprokázal. Prediabetes byl diagnostikovaný na základě oGTT i v Da Qing Diabetes Prevention Outcome Study započaté roku 1986, v níž je většina pacientů sledována doposud. Pomocí úpravy životního stylu (fyzická aktivita, dietní opatření nebo jejich kombinace) bylo dosaženo snížení incidence kardiovaskulárních příhod (HR 0,74). Snížen byl výskyt úmrtí z kardiovaskulárních příčin (HR 0,67) i úmrtí celkových (HR 0,74). Prokázán byl i další benefit úpravy životního stylu, a to oddálení nástupu DM v průměru o 4 roky.
Nefarmakologická léčba pomocí úpravy životního stylu je tedy účinná v prevenci progrese PGT do DM a redukci rizika KVO a je základem terapie. Při vědomí výše uvedených patofyziolgických procesů je zjevné, že část medikamentózních i nemedikamentózních terapeutických zásahů, které uvádíme v textu, mají svůj potenciál nejen v „makroskopických“ ukazatelích, jakými jsou např. glykemie, HbA1c, hladiny lipidů, hodnoty krevního tlaku, ale projeví se přímo či nepřímo i na „mikroskopické“ úrovni v podobě zlepšení endoteliální dysfunkce a fibrinolytických schopností endotelu.13,32,23
Soubor opatření by měl zahrnovat zanechání kouření i vyvarování se pasivní expozici, úpravu stravovacích zvyklostí a provozování fyzické aktivity v rámci obvyklých doporučení. U pacientů s nadváhou nebo obezitou by cílem měla být redukce váhy. Dietní opatření závisí na současných návycích pacienta, obecně je doporučeno snížit kalorický příjem a preferována je středomořská strava. Konzumace kávy a čaje ani ve zvýšeném množství nezvyšuje pravděpodobnost KVO ani DM, ale naopak jejich výskyt zřejmě snižuje. Suplementace vitaminů a mikronutrientů s cílem snížit výskyt KVO a DM není doporučena. Fyzická aktivita by měla zahrnovat aerobní i odporový trénink a trvat by měla minimálně 150 min týdně, možným schématem je např. 30 min 5-krát týdně. Výhodou nefarmakologické terapie je její účinek nejen na samotný prediabetes, ale také na případné komorbidity, které nezávisle zvyšují riziko kardiovaskulárních příhod, a to zejména na hypertenzi a dyslipidemii.
Farmakoterapie u prediabetu je stále se vyvíjející problematikou a zatím chybí důkazy stran redukce kardiovaskulárního rizika. Metformin může být zvážen za účelem prevence progrese do DM zejména u rizikových pacientů, tzn. s BMI ≥ 35 kg/m2, historií gestačního diabetes mellitus, mladších 60 let či s dalšími rizikovými faktory. Účinnost tohoto postupu se v různých studiích liší. U pacientů v Diabetes Prevention Program byl méně účinný než úprava životního stylu, v čase se však rozdíly zmenšovaly. U vybraných skupin pacientů s rizikovými faktory v téže studii byl naopak účinek na podobné úrovni jako nefarmakologická terapie prokázán. V současnosti zůstává prediabetes off-label indikací metforminu.33,34 Zkoumány byly i kombinace metforminu s pioglitazonem a trojkombinace s agonistou GLP-1R, které snížily riziko progrese do DM u rizikových pacientů (HR 0,29, resp. 0,12). Dlouhodobé účinky léčby metforminem na KVO jsou v současnosti předmětem testování, nicméně výsledky nelze očekávat dříve než v roce 2024 (VA-IMPACT, GLINT).
Kromě samotného prediabetu je nutné vyhledávat a léčit komorbidity, jako je arteriální hypertenze a dyslipidemie. Ve farmakoterapii arteriální hypertenze by měly být preferovány inhibitory renin-angio-tenzin-aldosteronového systému před betablokátory (BB) a diuretiky. Kombinace BB a diuretika zvyšuje riziko progrese prediabetu do DM, zatímco valsartan toto riziko snižuje a ramirpil podporuje reverzi do normoglykemie. Cílové hodnoty systolického krevního tlaku by neměly přesahovat 130 mmHg, další snižování zřejmě nepřináší celkový benefit, ale dle některých studií snižuje incidenci CMP. Léčba dyslipidemie je zásadní, ale v současnosti není doporučena modifikace postupu u pacientů s prediabetem.32
Závěr
Podle aktuálních znalostí se pravděpodobnost výskytu ICHS zvyšuje s rostoucí hladinou glykemie na lačno i v rámci prediabetického rozmezí. V pásmu glykemií 5,6–6,0 mmol/l je riziko ICHS 1,11, v rozmezí 6,1–6,9 mmol/l je toto riziko 1,17. Díváme-li se na prediabetes prizmatem HbA1c, pak je riziko ICHS 1,28 v rozmezí hodnot HbA1c 42–47 mmol/mol. Pravděpodobnost přítomnosti ICHS tedy s narůstající glykemií stoupá, tato závislost však není lineární a byla prokázána pro prediabetes definovaný podle všech používaných diagnostických kritérií. Tyto výsledky jsou dalším faktorem ukazujícím na význam screeningu prediabetu v populaci.
Literatura
- Qazi MU, Malik S. Diabetes and Cardiovascular Disease: Insights from the Framingham Heart Study. Glob Heart 2013; 8: 43–48.
- Low Wang CC, Hess CN, Hiatt WR, et al. Clinical Update: Cardiovascular Disease in Diabetes Mellitus. Circulation 2016; 133: 2459–2502.
- Kannel WB, McGee DL. Diabetes and cardiovascular risk factors: the Framingham study. Circulation 1979; 59: 8–13.
- Gregg EW, Li Y, Wang J, et al. Changes in Diabetes-Related Complications in the United States, 1990–2010. N Engl J Med 2014; 370: 1514–1523.
- Roglic G. Global report on diabetes. Geneva, Switzerland: World Health Organization 2016.
- Haffner SM, Lehto S, Rönnemaa T, et al. Mortality from Coronary Heart Disease in Subjects with Type 2 Diabetes and in Nondiabetic Subjects with and without Prior Myocardial Infarction. N Engl J Med 1998; 339: 229–234.
- Whiteley L, Padmanabhan S, Hole D, et al. Should Diabetes Be Considered a Coronary Heart Disease Risk Equivalent? Results from 25 years of follow-up in the Renfrew and Paisley Survey. Diabetes Care 2005; 28: 1588–1593.
- Di Angelantonio E, Kaptoge S, Worrmser D, et al. Association of Cardiometabolic Multimorbidity With Mortality. JAMA 2015; 314: 52–60.
- Škrha J. Kardiovaskulární mortalita u diabetu. Vnitř Lék 2017; 63: 447–449.
- Gregg EW, Li Y, Wang J, et al. Changes in Diabetes-Related Complications in the United States, 1990–2010. N Engl J Med 2014; 370: 1514–1523.
- Rawshani A, Rawshani A, Franzén S, et al. Mortality and Cardiovascular Disease in Type 1 and Type 2 Diabetes. N Engl J Med 2017; 376: 1407–1418.
- Brož J, Honěk P, Dušek L, et al. The mortality of patients with diabetes mellitus using oral antidiabetic drugs in the Czech Republic decreased over the decade of 2003–2013 and came closer to the population average. Vnitř Lék 2015; 61(Suppl. 3): 14–20.
- Perušičová J, Pelikánová T, Škrha J, et al. Doporučený postup péče o nemocné s prediabetem. DMEV 2012; 15: 20–22.
- Rett K, Gottwald-Hostalek U. Understanding prediabetes: definition, prevalence, burden and treatment options for an emerging disease. Curr Med Res Opin 2019; 35: 1529–1534.
- Chatterton H, Younger T, Fischer A, et al. Risk identification and interventions to prevent type 2 diabetes in adults at high risk: summary of NICE guidance. BMJ 2012; 345: e4624–e4624.
- Buysschaert M, Medina JL, Buysschaert B, et al. Definitions (and Current Controversies) of Diabetes and Prediabetes. Current Diabetes Reviews 2015; 12: 8–13.
- Tabak AG, Herder C, Rathmann W, et al. Prediabetes: a high-risk state for diabetes development. Lancet. 2012; 379: 2279–2290.
- Tabak AG, Jokela M, Akbaraly TN, et al. Trajectories of glycaemia, insulin sensitivity, and insulin secretion before diagnosis of type 2 diabetes: an analysis from the Whitehall II study. Lancet 2009; 373: 2215–2221.
- International Diabetes Federation. IDF Diabetes Atlas. 2017 (Online) 8th ed. International Diabetes Federation: Brussels, Belgium 2017.
- Žejglicová K, Kratěnová J, Lustigová M, et al. Vybrané ukazatele zdravotního stavu české populace – výsledky studie EHES. Prakt Lek 2017; 97: 123–130.
- Čapková N, Lustigová M, Kratěnová J, et al. Vybrané ukazatele zdravotního stavu české populace – Studie EHES 2014. Hygiena 2017; 62: 35–37.
- Lustigová M, Čapková N. Prevalence rizikových faktorů srdečně-cévních onemocnění v Česku z pohledu demografických charakteristik – vybrané výsledky studie EHES. Demografie 2017; 59: 162–169.
- Wasserman DH, Wang TJ, Brown NJ. The Vasculature in Prediabetes. Circulation Research 2018; 122: 1135–1150.
- Stengård JH, Tuomilehto J, Pekkanen J, et al. Diabetes mellitus, impaired glucose tolerance and mortality among elderly men: The Finnish cohorts of the seven countries study. Diabetologia 1992; 35: 760–765.
- Emerging Risk Factors Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet 2010; 375: 2215–2222.
- Ryden L, Standl E, Bartnik M, et al. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary: The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD). Eur Heart J 2006; 28: 88–136.
- Lee AK, Warren B, Lee CJ, et al. The Association of Severe Hypoglycemia With Incident Cardiovascular Events and Mortality in Adults With Type 2 Diabetes. Diabetes Care 2017; 41: 104–111.
- Huang Y, Cai X, Mai W, et al. Association between prediabetes and risk of cardiovascular disease and all-cause mortality: systematic review and meta-analysis. BMJ 2016; 355: i5953.
- Açar B, Ozeke O, Karakurt M, et al. Association of Prediabetes With Higher Coronary Atherosclerotic Burden Among Patients With First Diagnosed Acute Coronary Syndrome. Angiology 2018; 70: 174–180.
- Vistisen D, Kivimäki M, Perreault L, et al. Reversion from prediabetes to normoglycaemia and risk of cardiovascular disease and mortality: the Whitehall II cohort study. Diabetologia 2019; 62: 1385–1390.
- Gong Q, Zhang P, Wang J, et al. Morbidity and mortality after lifestyle intervention for people with impaired glucose tolerance: 30-year results of the Da Qing Diabetes Prevention Outcome Study. Lancet Diabetes & Endocrinology 2019; 7: 452–461.
- Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. European Heart Journal 2020; 41: 566–570.
- Armato JP, Defronzo RA, Abdul-Ghani M, et al. Successful treatment of prediabetes in clinical practice using physiological assessment (STOP DIABETES). The Lancet Diabetes and Endocrinology 2018; 6: 781–789.
- Prevention or Delay of Type 2 Diabetes: Standards of Medical Care in Diabetes – 2019. Diabetes Care 2019; 42(Suppl. 1): S29–S33.
- Shaw JE Prediabetes: lifestyle, pharmacotherapy or regulation? Therapeutic Advances in Endocrinology and Metabolism 2019; 10: 128–133.


