Stanovisko ČSAT ke Konsenzu Evropské společnosti pro
aterosklerózu: Lipoprotein(a) při aterosklerotických
kardiovaskulárních onemocněních a aortální stenóze
Statement CSAT on Consensus statement of the European Atherosclerosis
Society: Lipoprotein(a) in atherosclerotic cardiovascular disease
and aortic stenosis
Michal Vrablík, Vladimír Blaha, Renata Cífková, Tomáš Freiberger, David Karásek, Pavel Kraml, Jan Piťha, Hana Rosolová, Vladimír Soška, Tomáš Štulc, Lukáš Zlatohlávek (za výbor ČSAT) a Jana Mašková
Preambule
V říjnu 2022 byl v European Heart Journal publikován konsenzus expertů o lipoproteinu(a) [Kronenberg et al. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement. Eur Heart J 2022; 43(39): 3925–3946].
Výbor České společnosti pro aterosklerózu (ČSAT) vypracoval na jeho základě následující souhrn nejdůležitějších informací pro českou odbornou veřejnost. Tento souhrn v českém jazyce ovšem nenahrazuje originální publikovaný konsenzus, a zájemcům o detailní znění proto doporučujeme k prostudování původní kompletní text. Číslování referencí v hranatých závorkách v tomto Stanovisku odpovídá původní publikaci.
Úvod
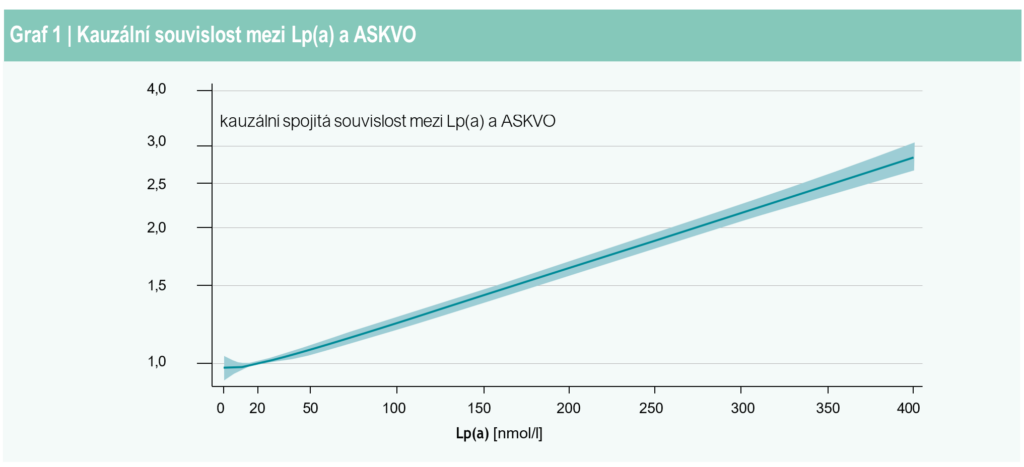
Od konsenzu European Atherosclerosis Society (EAS) z roku 2010 [1] došlo k podstatnému rozšíření znalostí o roli lipoproteinu(a)/Lp(a) při aterosklerotických kardiovaskulárních onemocněních (ASKVO) a stenóze aortální chlopně (AVS – Aortic Valve Stenosis), graf 1 a box 1. Přesvědčivé důkazy o příčinné souvislosti Lp(a) s ASKVO urychlily vývoj nových léčiv, která specificky snižují hladinu Lp(a). Velký přínos by tato léčiva mohla mít ve zpomalení progrese AVS [2,3], zřejmě posledního kardiovaskulárního onemocnění (KVO) bez dostupné léčby, u nějž se navíc předpokládá do roku 2050 dramatické zvýšení prevalence (> 300 %).
Co určuje hladinu Lp(a) v plazmě?
Vliv genetických faktorů na hladinu Lp(a)
Koncentrace Lp(a) se pohybuje v rozmezí od < 0,1 mg/dl do > 300 mg/dl (< 0,2–750 nmol/l) a převážně (> 90 %) ji určuje genetická variabilita v genu LPA. Polymorfizmus počtu repetic v oblasti Kringle IV (K-IV) je zodpovědný za ~30–70 % variability koncentrace hladin Lp(a). Exprese nízkého počtu (< 23) opakování K-IV je charakterizována malými izoformami apolipoproteinu(a)/apo(a) a výrazně vyšší koncentrací Lp(a), a tím i vyšším rizikem ASKVO. Mezi známými variantami LPA jsou jednonukleotidové polymorfizmy (SNP) rs10455872 a rs3798220 spojeny s malými izoformami apo(a) [12], nicméně přítomny jsou pouze u 50 % jedinců s malými izoformami [13]. Dvě z těchto variant, sestřihové varianty 4733G>A a 4925G>A (přítomny u 38 %, resp. 22 % populace) snižují hladinu Lp(a) o ∼14 a 30 mg/dl a souvisí s nižším kardiovaskulárním (KV) rizikem [15,16]. Kromě oblasti genu LPA mají s hladinou Lp(a) spojitost geny APOE, CETP a APOH [17–19].
Vliv etnicity a pohlaví
Na hladinu Lp(a) má vliv příslušnost k typu populace, resp. rasy – podle UK Biobanky se medián Lp(a) postupně zvyšuje u populace mongoloidní (asijské, především z oblasti Číny), kavkazoidní/europoidní, mongoloidní (především z oblasti Jihovýchodní Asie) a negroidní (16, 19, 31, resp. 75 nmol/l) [20, 21]. Podle prospektivní studie ARIC (Atherosclerosis Risk in Communities) se hodnoty Lp(a) mnohem více liší mezi negroidní než europoidní rasou [22], což dokládá skutečnost, že 50. percentil u příslušníků negroidní rasy odpovídá 80. percentilu u příslušníků europoidní rasy [22]. Tyto rozdíly mezi etniky lze připsat velikosti izoformy Lp(a) a genetické variabilitě v genu LPA.
Rozdíly v koncentraci Lp(a) jsou popsány i mezi pohlavími, obecně o ∼5–10 % vyšší je u žen než u mužů, a to u populace europoidní i negroidní [22,25,30]. U mužů zůstávají hladiny Lp(a) relativně konstantní, zatímco u žen dochází k nárůstu po menopauze [31].
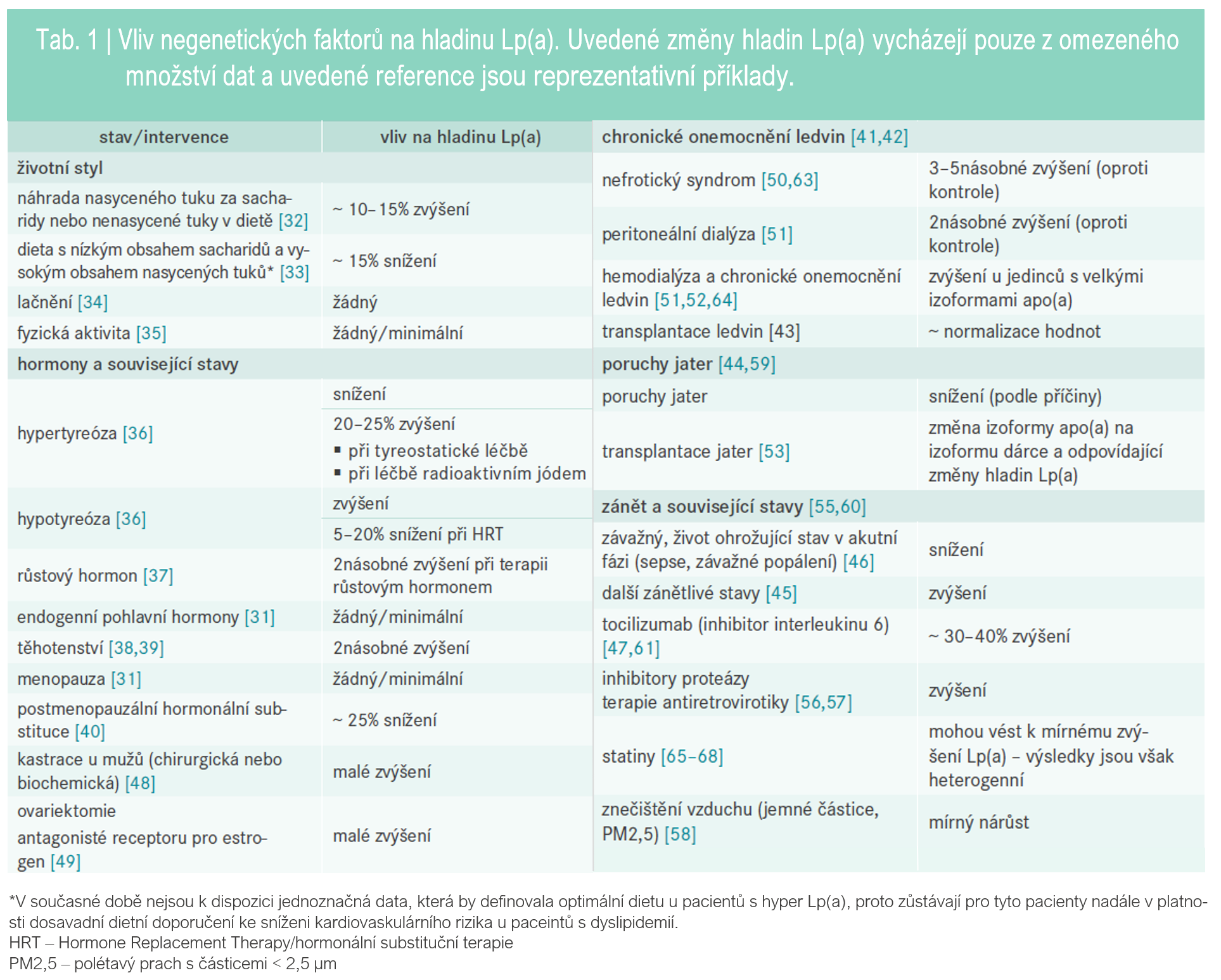
Vliv negenetických faktorů
Vliv negenetických faktorů na hladinu Lp(a) shrnuje tab. 1.
Novinky v epidemiologii Lp(a)
Většina jedinců má relativně nízké hladiny Lp(a). Studie se zaměřují na třetinu populace s nejvyššími hodnotami Lp(a), u kterých je proto riziko kardiovaskulární morbidity a mortality vyšší až o 20 % [20,69].
Primární prevence
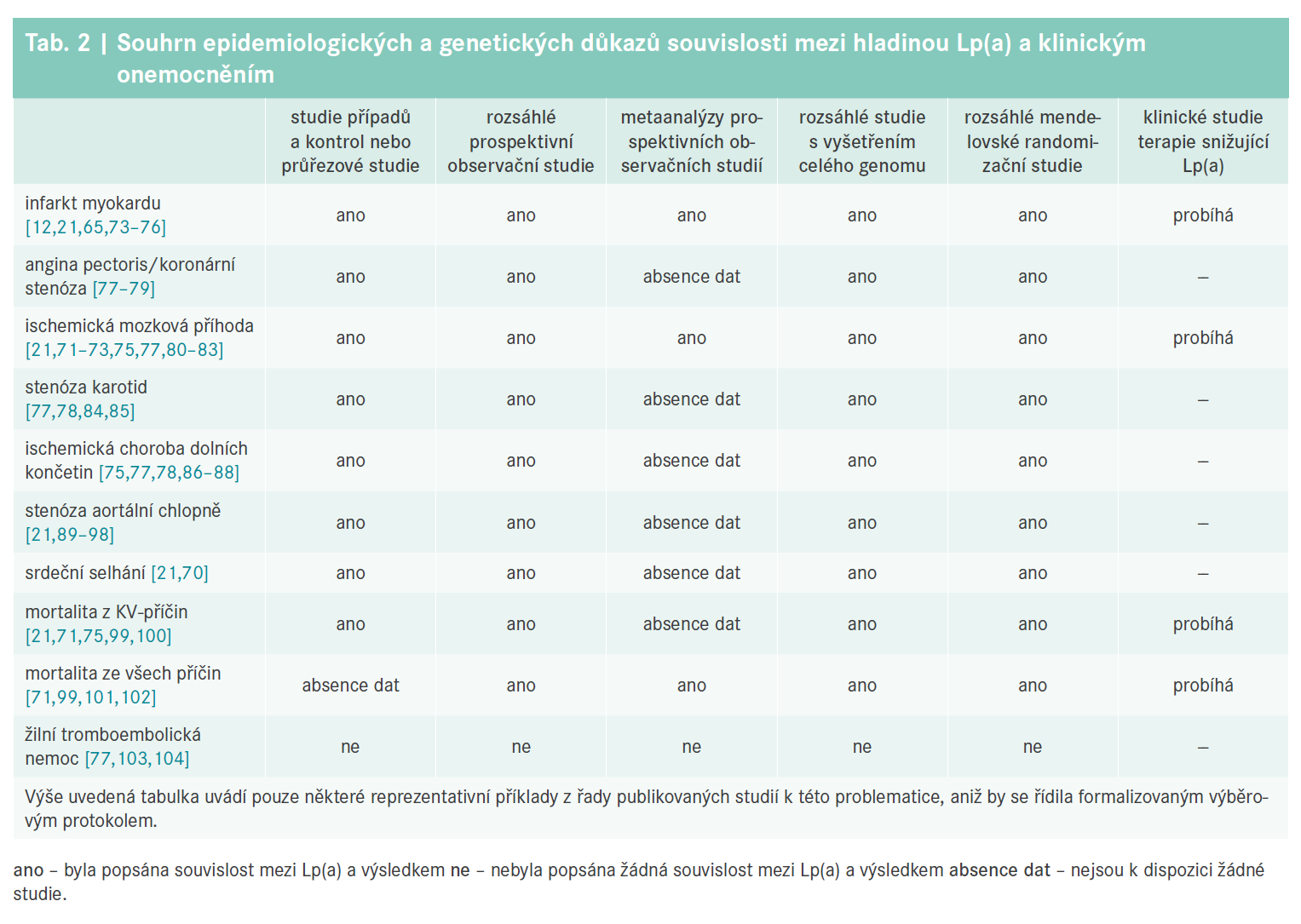
Zvýšené hladiny Lp(a) mají souvislost s několika ASKVO, stejně jako s AVS, s mortalitou z KV-příčin a mortalitou ze všech příčin (graf 2, tab. 2). Hodnoty Lp(a) > 75. percentil zvyšují riziko AVS a infarktu myokardu (IM) a ještě vyšší hodnoty (> 90. percentil) dále zvyšují riziko srdečního selhání [70]. Riziko mortality z KV-příčin a ischemické mozkové příhody [71–73] vzroste při velmi vysokých hodnotách (> 95. percentil).
Sekundární prevence
V sekundární prevenci byla pozorována souvislost mezi zvýšeným Lp(a) a zvýšeným rizikem závažných nežádoucích KV-příhod (MACE – Major Adverse Cardiac Events) [105].
Lp(a) a stenóza aortální chlopně
Od roku 2013 byl na základě mnoha epidemiologických a genetických studií [90–98] gen LPA uznán jako hlavní faktor rozvoje AVS [89]. Vysoká hladina Lp(a) ovlivňuje mikrokalcifikaci a makrokalcifikaci aortální chlopně [109,110] zejména u relativně mladých zdravých jedinců (ve věku 45–54 let), u nichž se riziko AVS zvyšuje až 3násobně při Lp(a) > 80. percentil v porovnání s nižší hladinou (15,8 % vs 4,3 %, resp.) [111]. Vysoký Lp(a) rovněž urychluje progresi aortální stenózy, což v důsledku vede k časnější náhradě aortální chlopně nebo k úmrtí [109,112].
Lp(a) a další kardiovaskulární onemocnění
Role zvýšeného Lp(a) při určení rizika mozkové příhody je různá podle etiologie, přičemž hladina Lp(a) a genotyp LPA mají vztah k riziku nekardioembolické mozkové příhody [80,81]. Hladina Lp(a) > 100 nmol/l měla souvislost s rekurentními příhodami u pacientů s rozsáhlými cévními mozkovými příhodami, ale nikoliv u pacientů s fibrilací síní [82], a proto je zřejmě zvýšená hladina Lp(a) důležitějším rizikovým faktorem mozkové příhody u pacientů ve věku < 60 let [77,82,83].
Gen LPA je nejsilnějším z genetických prediktivních faktorů ischemické choroby dolních končetin [86]. Ačkoliv rozsáhlé studie popisovaly souvislost mezi zvýšeným Lp(a) a atriální fibrilací, výsledný vliv je relativně malý a částečně zprostředkovaný ASKVO a AVS [113,114].
Je Lp(a) kauzálním rizikovým faktorem ASKVO a AVS?
Příčinná souvislost mezi zvýšeným Lp(a) a ASKVO a AVS byla prokázána v mnoha studiích [1,8,9,12,71,72,74,77,115–118], podle kterých je dále hladina Lp(a) velmi silně určena geneticky, včetně izoformy apo(a) dané počtem K-IV repetic [74,118–120] a SNP (zejména rs10455872 a rs3798220) [12,75]. Genetické varianty spojené s vysokým Lp(a) jsou mnohem častěji u jedinců postižených KV-příhodami [8]. Naopak vzácné varianty se ztrátou funkce [121] a velmi časté varianty sestřihu v oblasti K-IV Typ 2 projevující se významně sníženými hladinami Lp(a) mají protektivní účinek vůči KV-příhodám [15,16].
Je vztah mezi koncentrací Lp(a) a ASKVO diskrétní, nebo lineární?
Riziko ASKVO se zvyšuje kontinuálně s rostoucí hladinou Lp(a) [20], a to již při koncentracích nižších než doporučených. I přes nedávné zpochybnění ve studii UK Biobank zůstává koncept hraniční hodnoty Lp(a) spojené s rizikem ASKVO pragmatickým nástrojem pro klinickou praxi (viz níže). Velmi vysoké hodnoty Lp(a) (> 180 mg/dl nebo > 430 nmol/l) identifikují jedince s celoživotním rizikem ASKVO, které je stejné jako u neléčené heterozygotní familiární hypercholesterolemie (FH) [126].
Je Lp(a) rizikovým faktorem při (velmi) nízké hladině LDL-C?
V rozsáhlé studii zaměřené na primární prevenci [127] asociace mezi Lp(a) a KV-rizikem vymizela při hodnotě LDL-C < 2,59 mmol/l. Tento výsledek je třeba interpretovat opatrně vzhledem k omezenému počtu pacientů a potenciálnímu nadhodnocení korekce LDL-C na Lp(a)-cholesterol [128]. Naopak ve studii JUPITER byl vztah mezi Lp(a) a první KV-příhodou podobný při hodnotách nad i pod mediánem hodnot LDL-C (2,84 mmol/l) [54], a dokonce i při nízkých hladinách LDL-C (1,40 mmol/l), čímž byl potvrzen význam vysokého Lp(a) jako faktoru reziduálního KV-rizika. Studie zaměřené na sekundární prevenci došly k podobným závěrům [65,107,108].
Je Lp(a) rizikovým faktorem tromboembolické příhody?
Při velmi vysoké hladině Lp(a) (> 95. percentil) bylo pozorováno pouze mírně zvýšené riziko tromboembolických příhod [77]. Žádná kauzalita nebyla pozorována ani v mendelovských randomizačních studiích [77,131].
Pediatričtí pacienti
U dětí se zvýšený Lp(a) klinicky neprojevuje až na vzácný výskyt cévní mozkové příhody. Omezená data svědčí o souvislosti mezi Lp(a) a případy cévní mozkové příhody (CMP) u dětí, která je ještě významnější u rekurentních příhod [132– 134], u nichž se riziko při hodnotě Lp(a) > 30 mg/dl zvyšuje 2násobně [132].
Hladina Lp(a) a diabetes
Během posledního desetiletí byla opakovaně pozorována souvislost mezi velmi nízkým Lp(a) a zvýšeným rizikem diabetes mellitus 2. typu (DM2T). V metaanalýze všech dostupných studií [79,135–141] bylo riziko vyšší o 38 % (95% CI 29–48 %; p < 0,0001) v 1. kvintilu – hranice < 3 až 5 mg/dl, vs v 5. kvintilu hladiny Lp(a) – hranice > 27 až 55 mg/dl, bez významné heterogenity mezi studiemi.
Jaký mechanizmus je zodpovědný za tuto souvislost, se neví a nelze jej ani vysvětlit tradičními rizikovými faktory nebo známými typy diabetu [143–145]. Rovněž není zřejmé, zda riziko souvisí s koncentrací Lp(a) nebo jinými faktory.
Otázku, zda účinné terapie snižující hodnoty Lp(a) mohou zvýšit riziko diabetes mellitus, bude nutné zařadit do analýzy přínosů a rizik nově vyvíjených léků. Při zvýšených hladinách (> 70 mg/dl) vyžadovaných pro zařazení do studie je však dosažení velmi nízké hladiny Lp(a) např. < 5 mg/dl velmi nepravděpodobné.
Pohled na metabolizmus
Klíčová část Lp(a) – apo(a) je syntetizován pouze v hepatocytech [53]. Protože velké izoformy apo(a) na rozdíl od malých izoforem apo(a) snáze podléhají degradaci proteazomy v endoplazmatickém retikulu, mají jejich nositelé nižší hladiny Lp(a) [146]. V kinetických studiích byla pozorována vyšší rychlost produkce apo(a) u jedinců s malými izoformami než s velkými izoformami [147].
Lp(a) je převážně metabolizován játry, v menší míře pak ledvinami. Receptor zodpovědný za vychytávání Lp(a) dosud nebyl s jistotou identifikován.
Jaký mechanizmus přispívá patogenitě Lp(a)?
Podobně jako LDL i Lp(a) je lipoprotein obsahující apoB, ale počet cirkulujících částic je mnohem nižší. Protože riziko spojené s Lp(a) přepočtené na jednu částici převyšuje riziko spojené s LDL [159], je aterogenita pravděpodobněji důsledkem buněčné signalizace než vlastní akumulace Lp(a). Podle zobrazovacích studií Lp(a) spouští zánět arteriální stěny [160] a u pokročilé ischemické choroby srdeční jsou vysoké hladiny Lp(a) spojené s urychlením progrese kalciového skóre v koronárním řečišti [161] a objemu nekrotické tkáně [162]. Podobně u AVS vysoké hladiny Lp(a) a jejich transportních proteinů (např. autotaxin) v intersticiálních buňkách chlopně indukují expresi prozánětlivých a prokalcifikačních genů, což vede ke zvýšení incidence a progrese AVS [112,163,164].
Oxidované fosfolipidy (OxPL), přenášené částicemi Lp(a) v plazmě, mají zřejmě hlavní roli v prozánětlivém a prokalcifikačním účinku Lp(a) [165]. Identifikace klíčových genů, které regulují glykolýzu v endoteliálních buňkách exponovaných vysokým hladinám Lp(a), ukazuje, že glykolýza je řídícím mechanizmem zánětu vyvolaného Lp(a) [166]. Podle dalších studií OxPL v částicích Lp(a) spouští sekreci chemoatraktantů a cytokinů, nadbytek adhezních molekul a transendoteliální migraci monocytů. U pacientů se zvýšeným Lp(a) byla potvrzena vyšší migrace imunitních buněk do aterosklerotických plátů [160]. OxPL v intersticiálních buňkách chlopní indukují expresi klíčových genů osteoblastických dějů [112], avšak účinek oslabují protilátky proti OxPL.
Není jisté, zda má Lp(a) nějakou roli v trombotických procesech (zvýšená koagulace nebo narušená fibrinolýza) [167], protože apo(a) obsahuje doménu podobnou proteáze, která připomíná doménu plazminogenu, avšak projevuje určitou aktivitu. Zásadní snížení hladiny Lp(a) nemělo u lidí žádný vliv na fibrinolýzu [168] a ani žádné epidemiologické ani genetické studie neprokázaly vliv zvýšeného Lp(a) na žilní trombózu [77,131].
Jak zahrnout riziko ASKVO spojené s Lp(a) do odhadu rizika?
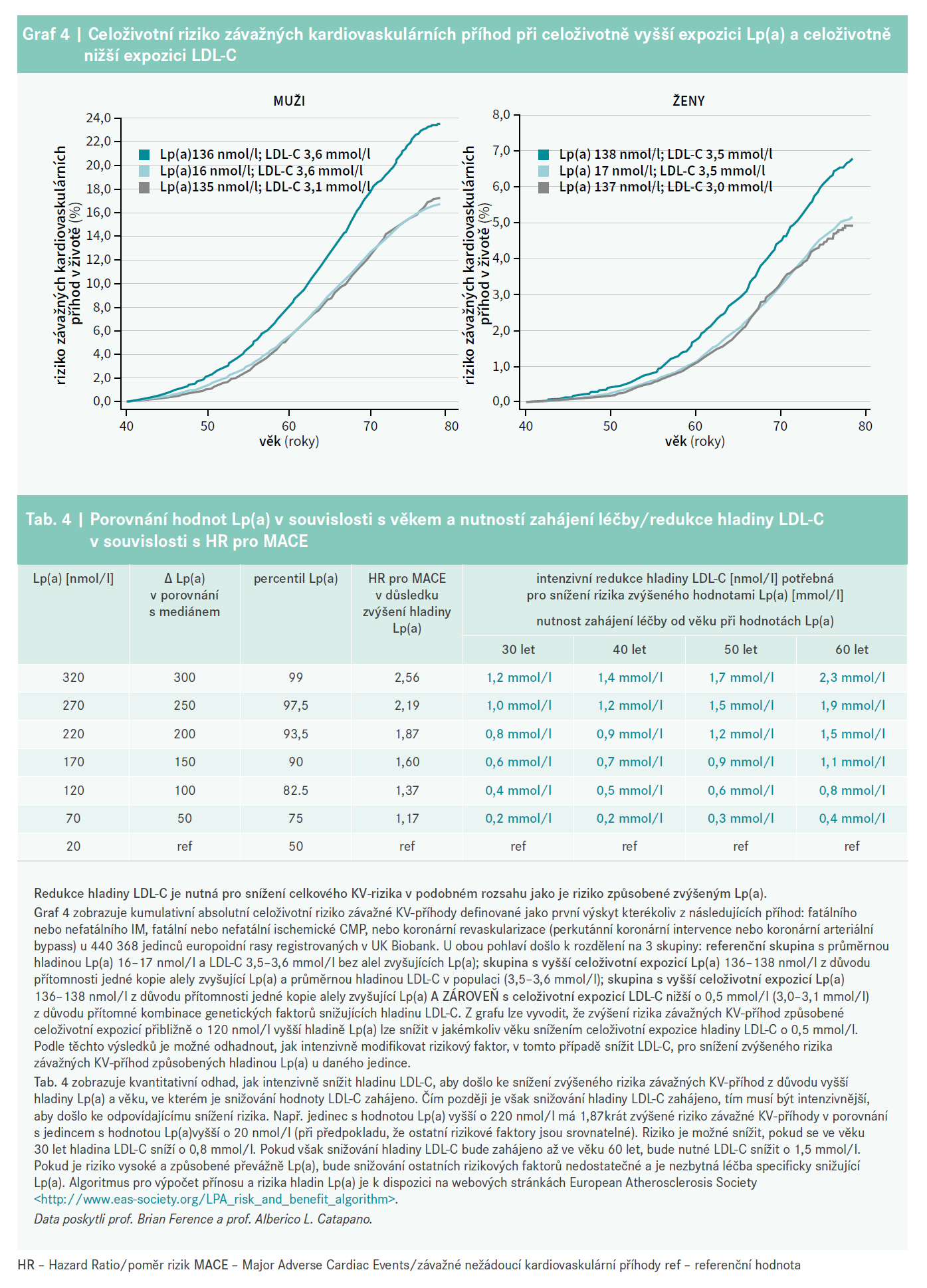
Podle stanoviska EAS z roku 2010 [1], které se stalo základem pro doporučení v Evropě a Spojených státech, byla pro zpřesnění odhadu 10letého rizika ASKVO stanovena hraniční hodnota Lp(a) – 50 mg/dl [116,126]. Vzhledem k přímo úměrnému vztahu mezi koncentrací Lp(a) a absolutním rizikem ASKVO [169] je vhodnější odhadovat, o kolik hladina Lp(a) zvyšuje celkové riziko ASKVO jedince, při současném zvážení jeho hodnoty Lp(a) a základního absolutního celkového rizika ASKVO. Jak ukazuje graf 3, hladina Lp(a) 100 mg/dl (∼ 250 nmol/l) přibližně zdvojnásobuje riziko ASKVO bez ohledu na základní absolutní riziko. U jedinců s vyšším počátečním rizikem je absolutní navýšení rizika ASKVO vyšší (např. z 20 % na 40 %) než u jedinců s nižším počátečním rizikem (z 5 % na 10 %).
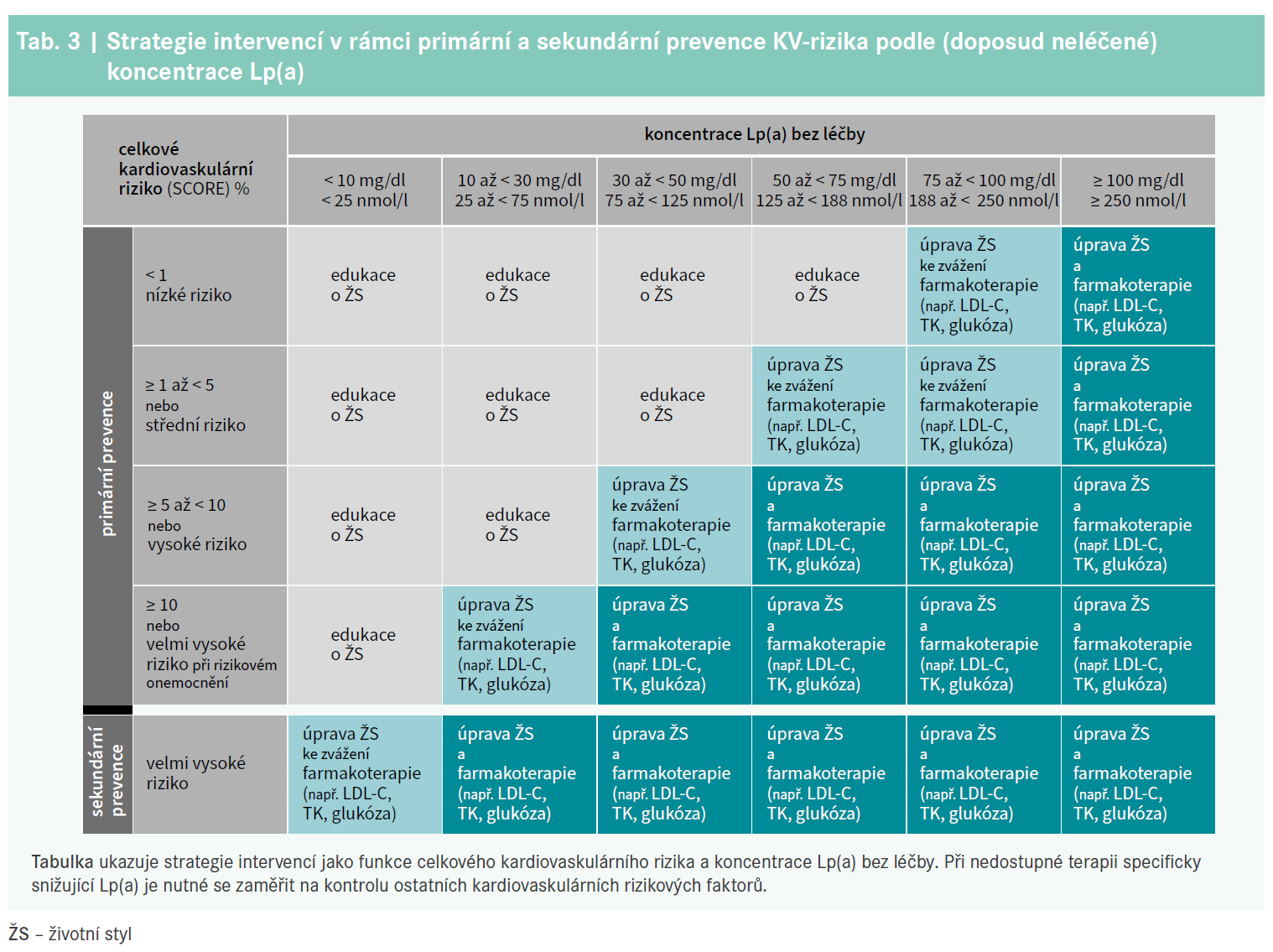
Tento konsenzus proto doporučuje se zvyšující se hladinou Lp(a) a zvyšujícím se základním rizikem intenzivnější léčbu rizikových faktorů, tj. personalizovanou úpravu KV-rizika (tab. 3). Nárůst celkového KV-rizika způsobený zvýšeným Lp(a) by měl odpovídat míře, v jaké je nutné navíc oproti doporučením snížit LDL-C, aby riziko opět kleslo na základní úroveň (graf 4 a tab. 4). Stejným způsobem lze vypočítat nový cíl pro snížení krevního tlaku, nebo jiné intervence. U pacientů, u kterých má Lp(a) na celkové riziko zásadní vliv, může být úprava ostatních rizikových faktorů pro snížení tohoto rizika nedostatečná. V těchto případech bude mít velký přínos léčba snižující specificky Lp(a).
Vyšetření hladiny Lp(a)
Kdo má vyšetření Lp(a) podstoupit?
V souladu s posledními evropskými [126] a kanadskými doporučeními [175] by hladina Lp(a) měla být u dospělých vyšetřena alespoň 1krát, ideálně při stanovení prvního lipidového profilu s cílem identifikovat jedince s vysokým KV-rizikem. Kromě několika výjimek (např. onemocnění ledvin nebo jater, akutní infekce) opakované měření nevede k vylepšení predikce rizika [67].
U dospívajících se měření Lp(a) doporučuje při ischemické mozkové příhodě v anamnéze, nebo jestliže rodič má předčasné ASKVO bez jiného identifikovatelného rizikového faktoru [115]. Opakování vyšetření je vhodné, protože hodnoty se mohou do dosažení dospělosti zvyšovat [6,7].
Je u Lp(a) vhodné kaskádové vyšetřování?
Vyšetření hodnot Lp(a) u rodičů a sourozenců pacienta je vzhledem k možné existenci a dalšímu nárůstu KV-rizika oprávněné [177]. Jako výhodné se jeví využít již zavedených procesů kaskádového testování FH [178–180].
Obtíže spojené se stanovením hladiny Lp(a)
Měření hladiny Lp(a) je obtížné [181]. Ideálně by vyšetření mělo spočívat v použití protilátek pro unikátní nerepetitivní epitopy na apo(a), které rozliší každou částici Lp(a) pouze jednou a výsledek lze prezentovat v jednotkách nmol/l. V praxi je však vytvoření takových protilátek obtížné, a proto většina vyšetření využívá polyklonální protilátky, které rozeznávají různé epitopy a potenciálně výsledek nadhodnotí, nebo podhodnotí podle přítomnosti malých nebo velkých izoforem apo(a). Zásadním zlepšením měření hodnot Lp(a) bude standardní postup vyšetření, který aktuálně vytváří pracovní skupiny [183,184].
Je možné koncentraci Lp(a) konvertovat z jednotek hmotnostních na molární a naopak?
Přísně vzato nelze výsledky měření pomocí polyklonálních protilátek uvádět v molárních jednotkách [181]. Kompromisem je srovnání s výsledky metody, která není citlivá na izoformu apo(a) a používá molární jednotky [183–185]. Tento konsenzus nedoporučuje používat standardní přepočet 2–2,5 násobek mezi mg/dl a nmol/l, protože metody se významně liší [186].
Důsledky hraničních hodnot pro stanovení rizika?
Souvislost mezi hodnotou Lp(a) a rizikem KVO je lineární, avšak v klinické praxi hraniční hodnoty pomáhají určit klinicky významné zvýšení rizika, přestože jejich obtížné stanovení může zpochybňovat jejich validitu. Řešením by mohly být specifické referenční hodnoty vyšetření, analogické vyšetřením různých kardiálních troponinů [187]. Tento konsenzus navrhuje pragmatický přístup s hraničními hodnotami pro „vyloučení“ (< 30 mg/dl nebo < 75 nmol/l), nebo „potvrzení“ (> 50 mg/dl nebo > 125 nmol/l) rizika. Intermediární/přechodná zóna (tj. 30–50 mg/dl; 75–125 nmol/l) bude aplikována při hodnocení rizika způsobeného Lp(a) v přítomnosti jiných rizikových faktorů a při stratifikaci rizika [181]. Laboratoře by ve zprávách s výsledky měly uvádět i název metody, aby bylo možné zhodnotit rozdílné výsledky při dalších kontrolách pacienta.
Měl by se cholesterol obsažený v Lp(a) použít pro snížení LDL-C?
Cholesterol obsažený v částicích Lp(a) nelze oddělit od cholesterolu v částicích LDL, a proto se uvádí společně jako koncentrace LDL-C. Podle předchozích analýz izolovaných částic Lp(a) tvoří cholesterol 30–45 % hmotnostní koncentrace Lp(a) [188,189]. Množství cholesterolu v Lp(a) [Lp(a)-C] se proto tedy odhaduje tak, že se koncentrace Lp(a) vyjádřená v mg/dl vynásobí koeficientem 0,3, a používá se takto jako korekce LDL-C: Lp(a)-C minus korigovaný LDL-C.
Tento postup má však svá omezení, protože přímé měření obsahu cholesterolu v poměru k hmotnosti částice Lp(a) ukázalo na velikou interindividuální i intraindividuální variabilitu v rozmezí 6 % až 60 % [128]. Proto tento konsenzus tedy korekci LDL-C podle Lp(a)-C v běžné praxi nedoporučuje. Jedinou výjimkou mohou být pacienti s klinicky suspektní FH [190] a zvýšenými hodnotami Lp(a), u nichž korekce může upřesnit nebo vyloučit diagnózu [191,192]. Vzhledem k tomu, že gen LPA byl identifikován jako příčina rezistence vůči statinům a Lp(a)-C je považován za frakci LDL-C rezistentní ke statinům [193], korekce LDL-C na Lp(a)-C může odlišit pacienty s vyšší základní hladinou Lp(a) a sníženou léčebnou odpovědí vůči statinům.
Je vhodné genetické testování?
Měření koncentrace Lp(a) je pro odhad rizika souvisejícího s Lp(a) dostatečné bez potřeby určení genotypu, polygenních rizikových skóre, nebo vyšetření velikostí exprimovaných izoforem apo(a) [194].
Klinické doporučení: Jak postupovat u pacienta se zvýšenou hladinou Lp(a)
Protože není k dispozici žádná schválená léčba snižující specificky Lp(a), doporučujeme u jedinců se zvýšenou hladinu Lp(a) časnou a intenzivní léčbu ostatních rizikových faktorů v souladu s příslušnými doporučeními [126,175]. Pro dostatečné snížení rizika ASKVO, při kterém bude uspokojivě potlačeno navýšení rizika způsobené zvýšenou hladinou Lp(a), se doporučuje personalizovaná úprava LDL-C, krevního tlaku, glykemie a životního stylu ve vztahu k základnímu KV-riziku a k zvýšené hladině Lp(a) bez léčby – viz níže. Kontrola hladiny LDL-C má probíhat v souladu s aktuálními doporučeními [126,175]. Ačkoliv statiny mohou mírně zvýšit hladinu Lp(a) [65–68], léčba se nemá ukončovat, protože její KV-benefit u pacientů s vysokým Lp(a) mnohonásobně převyšuje jakékoliv potenciální riziko z mírného navýšení Lp(a) [65,195]. Lipoproteinovou aferézu lze zvážit u pacientů s velmi vysokým Lp(a) a pokročilým KVO navzdory optimální léčbě jiných rizikových faktorů, protože dostupná data z nekontrolovaných studií svědčí o jejím přínosu [196,197].
Ve většině studií s inhibitory proproteinových konvertáz subtilizin-kexinového typu 9 (PCSK9) došlo při této léčbě k významnějšímu poklesu absolutního KV-rizika při vyšší hladině Lp(a) v době zařazení. Ve studii FOURIER bylo absolutní riziko sníženo o 2,41 % versus 1,41 % při Lp(a) > 50 versus < 50 mg/dl [198] a ve studii ODYSSEY OUTCOMES o 3,7 % při Lp(a) > 60 mg/dl versus 0,5 % u pacientů s Lp(a) v nejnižším kvartilu [199]. Inhibitory PCSK9 však nejsou registrovány pro snižování Lp(a).
Niacin se vzhledem k nedostatečnému klinickému přínosu ve dvou studiích nedoporučuje [200,201]. Rovněž podle současných dat nelze doporučit dávkování aspirinu podle hladiny Lp(a) [202].
Nová léčiva ve výzkumu
Nově vyvíjenými přípravky pro snížení Lp(a) jsou antisense a malé interferující (small interfering) molekuly RNA (siRNA) zacílené na syntézu apo(a) v hepatocytech [203]. V klinických studiích časné fáze antisense oligonukleotidu pelakarsenu – dříve TQJ230 a AKCEA-APO(a)-LRx – podávaného v dávce 20 mg 1krát týdně a 60 mg 1krát za 4 týdny byl pozorován pokles o 80 %, resp. 72 %, přičemž na konci klinické studie dosáhlo 98 % , resp. 81 % pacientů hladiny Lp(a) < 125 nmol/l [204]. U olpasiranu, (dříve AMG890), malé interferující siRNA konjugované s N-acetylgalaktosaminem (GalNAc), došlo k po klesu v rozmezí 71 % a 97 %, který přetrval více než 6 měsíců [205]. Oba přípravky mají příznivý bezpečnostní profil. Jiná siRNA konjugovaná s GalNAc (SLN360, Silence Therapeutics) je v časné fázi vývoje [206].
O kolik je nutné Lp(a) snížit, aby se projevil příznivý efekt?
Ačkoliv se odhady liší, pro klinicky významný pokles rizika příhod ASKVO v „blízké době“ (< 5 let) je podle několika krátkodobých randomizovaných studií potřeba dosáhnout velkého absolutního snížení koncentrace Lp(a) (> 50–100 mg/dl) [107,169,207]. Přesná data však dosud nejsou k dispozici.
Snižování Lp(a) u stenózy aortální chlopně
K dispozici jsou robustní důkazy o tom, že počátek onemocnění aortální chlopně, zvýšená aktivita onemocnění a jeho progrese mají kauzální souvislost s vysokou koncentrací Lp(a) [93,112]. V současnosti jsou však nutné randomizované kontrolované studie vlivu snižování Lp(a) na progresi AVS, pro které je však velmi náročné vybrat vhodnou populaci pacientů a sledované parametry [110].
Dopady na klinickou praxi a úskalí
Ačkoliv zavedení principů péče o jedince se zvýšenými hodnotami Lp(a) do klinické praxe může být náročné, jako model může posloužit péče o pacienty s FH a jejich rodiny [179]. Zásadní je zvyšování všeobecného povědomí o důležitosti úpravy zvýšené hladiny Lp(a) a školení širokého spektra zdravotníků v této problematice [208].
Závěr
Tento konsenzus EAS 2022 aktualizuje důkazy související se vztahem hodnot Lp(a) k výskytu ASKVO, důrazně podporuje klinická doporučení a jejich zařazení do odhadu celkového rizika. Klíčové je zlepšení standardizace měření hodnot Lp(a) společně se zavedením stejných modelů péče jako u FH.
Mezery v našich znalostech o Lp(a) nicméně přetrvávají (box 2). Stěžejní je otázka, zda snížení zvýšených hodnot Lp(a) při dobře kontrolovaných hladinách LDL-C vede k poklesu rizika kardiovaskulárních příhod. V tomto směru budou zásadní výsledky ze studie HORIZON zaměřené na vliv snižování hladiny Lp(a) na MACE u pacientů s KVO. V neposlední řadě je prioritou zjištění potenciálu, který má snížení hladin Lp(a) na snížení progrese AVS.
TF podpořen projektem Národní institut pro výzkum metabolických a kardiovaskulárních onemocnění (Program EXCELES, ID: LX22NPO5104) – Financováno Evropskou unií – Next Generation EU.
Literatura
Číselné označení citované literatury odkazuje na citace v originální verzi Konsenzu:
Kronenberg F, Mora S, Stroes ESG et al. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: A European Atherosclerosis Society consensus statement. Eur Heart J 2022: 43(39): 3925–3946. Dostupné z DOI: <https://doi.org/10.1093/eurheartj/ehac361>.
Článok bol prevzatý a uverejnený so súhlasom autora a odbornej redakcie Atheroreview a zároveň s láskavým súhlasom hlavného odborného redaktora prof. M. Vrablíka a vydavateľstva Facta Medica, s. r. o. Článok bol po prvý krát uverejnený v časopise AtheroRev 2023; 8(2): 66–76