Účinnost inzulinu glargin 300 U/ml u pacientů s diabetem 2. typu nedostatečně kompenzovaných léčbou bazálním inzulinem v podmínkách běžné klinické praxe v České republice
rof. MUDr. Martin Prázný, CSc., Ph.D., FRCP (Edin)1; MUDr. Milan Flekač, Ph.D.1; MUDr. Petr Jelínek, MBA2; Jana Mašková3 1III. interní klinika VFN a 1. LF UK, Praha; 2Sanofi, Praha; 3NEOX Clinical Research, Praha
Souhrn Cílem studie bylo zhodnotit klinickou účinnost inzulinu glargin 300 U/ml (Gla-300) v léčbě pacientů s diabetem 2. typu (DM2) nedostatečně kompenzovaných bazálním inzulinem v podmínkách běžné klinické praxe v České republice (studie TOPAZ). TOPAZ byla prospektivní multicentrická neintervenční studie trvající 6 měsíců. Z 312 pacientů zapojených do studie bylo po 6 měsících hodnoceno 289. Primárním sledovaným parametrem byla změna HbA1c po 6 měsících. Jako sekundární cíle byly hodnoceny podíl pacientů s HbA1c < 7 % (< 53 mmol/mol), podíl pacientů s poklesem HbA1c nejméně o 0,5 % po 6 měsících, změna glykemie nalačno (FPG), tělesná hmotnost a dávka inzulinu po 3 a 6 měsících. Vyhodnocen byl také výskyt hypoglykemií, nežádoucích událostí a spokojenost pacientů s léčbou. HbA1c významně poklesl po 6 měsících (průměrná změna 0,9 ± 1,1 % [–9,9 ± 11,6 mmol/mol]; p < 0,0001). Cílový HbA1c < 7 % byl dosažen u 17,6 % pacientů, 66 % pacientů vykazovalo průměrný pokles HbA1c o 0,5 ± 0,8 %. Po 6 měsících klesla FPG (průměrná změna od počátku –1,8 ± 3,1 mmol/l), stejně jako výskyt hypoglykemií o 49 % (p < 0,0001), a to bez nárůstu tělesné hmotnosti. Nebyly pozorovány žádné významné bezpečnostní signály. V podmínkách běžné klinické praxe byla změna léčby pacientů s DM2 nedostatečně kompenzovaných při léčbě jiným bazálním inzulinem na Gla-300 spojena se zlepšením kompenzace diabetu a snížením rizika hypoglykemie, a to bez nárůstu tělesné hmotnosti a se zvýšením spokojenosti pacientů s léčbou. Klíčová slova: glykemie nalačno, glykovaný hemoglobin, hypoglykemie, inzulin glargin (Gla-300 U/ml), běžná klinická praxe, diabetes 2. typu (DM2) Summary The aim of the study was to evaluate the clinical efficacy of insulin glargine 300 U/ml (Gla-300) in the treatment of patients with type 2 diabetes (DM2) insufficiently compensated by basal insulin in the conditions of routine clinical practice in the Czech Republic (TOPAZ study). TOPAZ was a prospective multicenter, non-interventional, 6-month study. Of the 312 patients enrolled in the study, 289 were evaluated at 6 months. The primary endpoint was the change in HbA1c at 6 months. The secondary endpoints were the proportion of patients with HbA1c < 7% (< 53 mmol/mol), the proportion of patients with a decrease in HbA1c of at least 0.5% after 6 months, the change in fasting glucose (FPG), body weight and insulin dose after 3 and 6 months. The incidence of hypoglycaemia, adverse events and patient satisfaction with treatment was also evaluated. HbA1c decreased significantly after 6 months (mean change 0.9 ± 1.1% [–9.9 ± 11.6 mmol/mol]; p < 0.0001). Target HbA1c < 7% was achieved in 17.6% of patients, 66% of patients showed a mean decrease in HbA1c of 0.5 ± 0.8%. After 6 months, FPG (mean change from baseline –1.8 ± 3.1 mmol/l) as well as the incidence of hypoglycaemia decreased by 49 % (p < 0.0001), without weight gain. No significant safety signals were observed. In routine clinical practice, a change in the treatment of patients with DM2 undercompensated with other basal insulin to Gla-300 was associated with improved diabetes compensation and a reduced risk of hypoglycaemia, without weight gain and increased patient satisfaction with treatment. Key words: fasting glucose, glycated hemoglobin, hypoglycemia, insulin glargine (Gla-300 U/ml), routine clinical practice, type 2 diabetes (DM2) Úvod Výskyt diabetu se celosvětově zvyšuje a toto onemocnění se stává závažným problémem nejen pro samotného pacienta, ale i pro celou společnost. Globální prevalence diabetu 2. typu (DM2) se od roku 1980 s nárůstem ze 4,7 % na 8,5 % u dospělých téměř zdvojnásobila. Tento nárůst je v první řadě ovlivněn celkovým životním stylem, zejména zvýšením počtu obézních osob v populaci.1,2 Odhaduje se, že v roce 2040 bude celosvětově trpět diabetem 642 milionů lidí.3,4 Změna životního stylu (úprava diety, fyzická aktivita, snížení tělesné hmotnosti, zanechání kouření) spolu s léčbou perorálními antidiabetiky jsou základními pilíři diabetologické péče.5–8 Včasné nasazení bazálního inzulinu je dobře osvědčené, zvláště v případě velmi vysokých hodnot HbA1c (> 11 % [> 97 mmol/mol]), přítomnosti příznaků hyperglykemie nebo jasných známek probíhajícího katabolismu (např. úbytku hmotnosti).7,8 Mezinárodní diabetologické organizace (ADA a EASD) doporučují bazální inzulin jako nejúčinnější léčbu u pacientů s nedostatečně kompenzovaným diabetem léčených nefarmakologickými opatřeními v kombinaci s jinými antidiabetiky.7,8 Kompenzace diabetu je jasně definována organizacemi ADA a EASD jako hladina HbA1c < 7,0 %.7,8 Inzulin glargin 300 U/ml (Gla-300), bazální inzulinový analog 2. generace, je schválen pro použití u dospělých pacientů s DM2, kteří nedosáhli dostatečné kompenzace diabetu pomocí nefarmakologických opatření (dietou a cvičením)9 v kombinaci s léčbou perorálními antidiabetiky. Tři studie III. fáze porovnávaly účinnost a bezpečnost Gla-300 s inzulinem glargin 100 U/ml (Gla-100) u různých populací pacientů s DM2.10–12 EDITION 1 zahrnovala účastníky s DM2 nedostatečně kompenzované léčbou bazálním a prandiálním inzulinem,10 zatímco EDITION 2 zahrnovala účastníky, kteří byli dříve léčeni bazálním inzulinem v kombinaci s perorálními antidiabetiky.11 Ve studii EDITION 3 byli zahrnuti pacienti dosud neléčení inzulinem, pouze s perorálními antidiabetiky.12 V těchto studiích porovnávajících inzuliny Gla-300 vs. Gla-100 byla dosažena srovnatelná kompenzace diabetu s nižším výskytem hypoglykemií u pacientů léčených Gla-300,10–13 nicméně vzhledem k tomu, že podmínky provedení randomizovaných kontrolovaných studií vždy neodpovídají reálné klinické praxi, jsou proto pro vytvoření rozhodovacího algoritmu stále častěji požadovány i důkazy z reálné praxe.14 Ačkoliv byl inzulin Gla-300 schválen k použití již na konci roku 2015, jsou k dispozici pouze omezené údaje o průkazu jeho účinnosti a bezpečnosti v reálné klinické praxi v České republice. Cílem této neintervenční studie bylo zhodnotit účinnost a bezpečnost změny léčby z jiného bazálního inzulinu na Gla-300 u pacientů s nedostatečně kompenzovaným DM2 v podmínkách běžné praxe. Metody Uspořádání studie, účastníci a výstupy TOPAZ byla prospektivní multicentrická národní observační jednoramenná studie trvající 6 měsíců, a jejím cílem bylo zhodnotit klinickou účinnost Gla-300 v léčbě pacientů s DM2 nedostatečně kompenzovaných jiným bazálním inzulinem v České republice. Do studie bylo zařazeno 312 pacientů, kteří podepsali informovaný souhlas v období od 25. května 2016 do 27. září 2017. Tato studie byla provedena v souladu s konsenzuálními principy15 včetně všech následných dodatků a byla schválena příslušnými etickými komisemi. Projekt byl dostupný pro pacienty, u kterých byla bezprostředně plánována změna léčby na Gla-300 nebo u kterých byla léčba Gla-300 zahájena 0–28 dnů před zařazením do studie. Kritéria pro zařazení byla diagnóza DM2, věk ≥ 18 let, HbA1c > 7,6 % (> 60 mmol/mol) nebo opakované hypoglykemie při léčbě humánním bazálním inzulinem, léčba bazálním inzulinem s neinzulinovými antidiabetiky nebo bez nich (nejméně 3 měsíce) a podepsaný informovaný souhlas. Vyřazovací kritéria byla diabetes mellitus 1. typu, léčba jakýmkoliv prandiálním inzulinem, těhotenství a kojení, aktuální účast v intervenční studii, věk < 18 let a nemožnost navštěvovat všechny plánované kontroly. Primárním sledovaným parametrem byla změna HbA1c od počátku do 6. měsíce sledování. Sekundárními sledovanými parametry byly: podíl pacientů s HbA1c < 7,0 % (< 53 mmol/mol), podíl pacientů s poklesem HbA1c od počátku do 6. měsíce sledování nejméně o 0,5 %, změna glykemie nalačno od počátku do 3. a 6. měsíce, změna tělesné hmotnosti od počátku do 3. a 6. měsíce, změna dávky Gla-300 od počátku do 3. a 6. měsíce, výskyt hypoglykemií (podíl účastníků s jednou nebo s více hypoglykemickými příhodami: symptomatickými, symptomatickými s prokázanou glykemií ≤ 3,9 mmol/l, závažnými a nočními), standardizovaná četnost hypoglykemických příhod (vypočítaná jako počet příhod na pacientorok), výskyt nežádoucích příhod (AE) a závažných nežádoucích příhod (SAE) v průběhu studie a spokojenost pacientů s léčbou (Dotazník spokojenosti s léčbou diabetu DTSQ).16 Sběr dat Na počátku byly zaznamenány následující parametry: demografické údaje, věk, pohlaví, tělesná hmotnost a výška, počáteční diagnóza, výskyt diabetických komplikací, osobní a farmakologická anamnéza, změny v ostatní medikaci v čase zahájení léčby inzulinem Gla-300, předchozí a aktuální antidiabetická terapie (perorální antidiabetika a inzulin), hodnota HbA1c a FPG (hodnoty časově nejblíže před zařazením/při zařazení/před zahájením léčby Gla-300), hodnota ALT, AST, LDL-cholesterol, kreatinin, hodnoty glykemie nalačno měřené pomocí selfmonitoringu (SMBG) (poslední 3 dostupná měření), rozhodnutí lékaře o zahájení léčby Gla-300, léčba Gla-300 (celková denní dávka, čas a datum zahájení léčby), cílová FPG, doporučení o titraci dávek Gla-300, hypoglykemie během posledních 3 měsíců před zařazením a DTSQ. Ve 3. a 6. měsíci byly zaznamenány následující parametry: tělesná hmotnost, aktuální antidiabetická léčba, aktuální léčba Gla-300, ostatní medikace, HbA1c, FPG, hodnoty SMBG nalačno (poslední 3 dostupná měření), výskyt hypoglykemií od předchozí kontroly (hlášené pacientem), výskyt AE od předchozí kontroly a DTSQ v 6. měsíci. AE a SAE byly zaznamenávány v průběhu celé studie. Statistické metody Analýza shromážděných údajů byla založena na deskriptivní statistice včetně absolutní a relativní četnosti samostatných proměnných. Kontinuální proměnné byly vyjádřeny počtem (bez chybějících údajů), průměrem a standardní odchylkou, mediánem, minimem a maximem. Diskrétní proměnné byly vyjádřeny počtem (absolutní četností) a procenty (relativní četností). Všechny statistické analýzy byly vyjádřeny s hladinou významnosti 5 % nebo 95 % intervalem spolehlivosti (confidence interval, CI). Nulová hypotéza, že změna HbA1c od počátku do 6. měsíce je rovna 0, byla analyzována neparametrickým jednovýběrovým Wilcoxonovým testem z důvodu nenormálního rozložení dat (potvrzeno pomocí Shapirova-Wilkova testu). Četnost výskytu hypoglykemií byla vypočítána pro každou kontrolu. Z důvodu nenormálního rozložení dat (potvrzeno pomocí Shapirova-Wilkova testu) byla nulová hypotéza, že není rozdíl v četnosti hypoglykemií v období před zahájením studie a před kontrolami ve 3. a 6. měsíci, analyzována pomocí neparametrického Friedmanova testu pro závislé opakované proměnné. V každé analýze byly zohledněny chybějící údaje. Doplnění chybějících údajů nebylo provedeno. Za předpokladu velikosti vzorku 259 pacientů a předpokladu odstoupení 15 % pacientů bylo plánováno do studie zahrnout 312 pacientů k získání dostatečných podkladů pro 90 % sílu analýzy a statistickou významnost výsledků. V této studii byly definovány dva soubory pacientů pro analýzu: soubor pro celkovou analýzu (n = 300) a soubor pro bezpečnostní analýzu (n = 312). Soubor pro celkovou analýzu zahrnoval všechny vhodné pacienty, kteří splňovali kritéria pro zařazení, nenaplňovali vylučovací kritéria a kteří užili nejméně jednu dávku Gla-300. Pokud byl pacient do studie zařazen nesprávně, byl vyřazen ze souboru pro celkovou analýzu podle Doporučení ICHE9.17 Soubor pro bezpečnostní analýzu se skládal z pacientů, kteří podepsali informovaný souhlas a kteří užili nejméně jednu dávku Gla-300. Soubor pro bezpečnostní analýzu byl použit pro hodnocení výskytu hypoglykemií, výskytu AE, SAE a pro hodnocení DTSQ. Nebyly prováděny žádné průběžné analýzy. Výsledky Z celkem 312 účastníků, kteří byli vybráni a podepsali informovaný souhlas mezi 25. květnem 2016 a 27. zářím 2017 na 55 vyšetřovacích místech, bylo 23 pacientů ze studie předčasně vyřazeno. Pro potřeby analýzy bylo proto na počátku k dispozici 300 hodnotitelných pacientů, 296 ve 3. a 289 v 6. měsíci.
Tabulka 1: Vstupní charakteristiky pacientů (Podle 1)
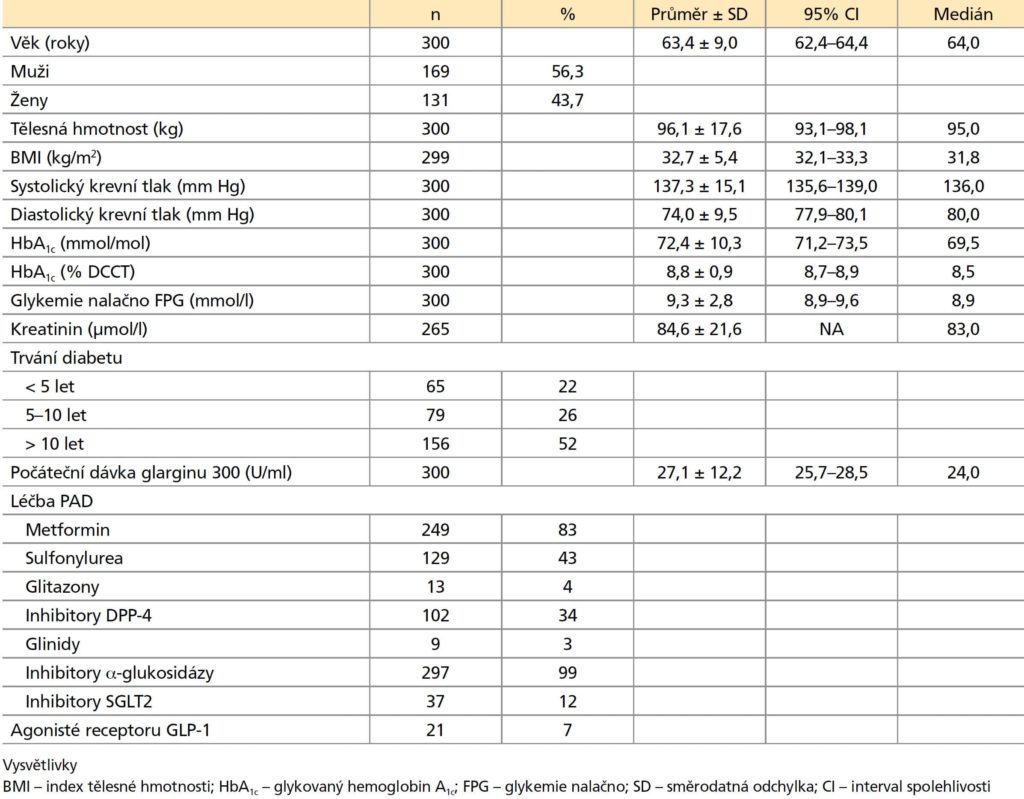 Vstupní charakteristiky pacientů
Vstupní charakteristiky pacientů
Z 300 pacientů bylo 56,3 % (169/300) mužů a 43,7 % (131/300) žen. Průměrný věk pacientů ve studii TOPAZ byl 63,4 ± 9,0 let. Počáteční charakteristika pacientů je shrnuta v tabulce 1. Bazální inzuliny užívané před výměnou za Gla-300 byly především Gla-100 (45 %), NPH (27 %) a inzulin detemir (28 %) (doplňující tabulka 2). Nejčastější komplikací diabetu byla neuropatie u 75 (25 %) pacientů, následovaná nefropatií u 53 (18 %) pacientů, retinopatií u 49 (16 %) pacientů, syndromem diabetické nohy u 7 (2 %) pacientů a amputací dolní končetiny u 1 (0,3 %) pacienta. Pacienti uváděli přítomnost následujících komorbidit: arteriální hypertenze u 265 (88 %), dyslipidemie u 248 (83 %), ischemická choroba srdeční u 61 (20 %), hypothyreóza u 36 (12 %), infarkt myokardu u 29 (10 %), ischemická choroba dolních končetin u 24 (8 %), srdeční selhání u 16 (5 %), iktus u 12 (4 %), tranzitorní ischemická ataka u 10 (3 %) a hyperthyreóza u 1 (0,3 %) pacienta.
Tabulka 2: Bazální inzuliny podávané pacientům před zahájením léčby inzulinem glargin Gla-300 U/m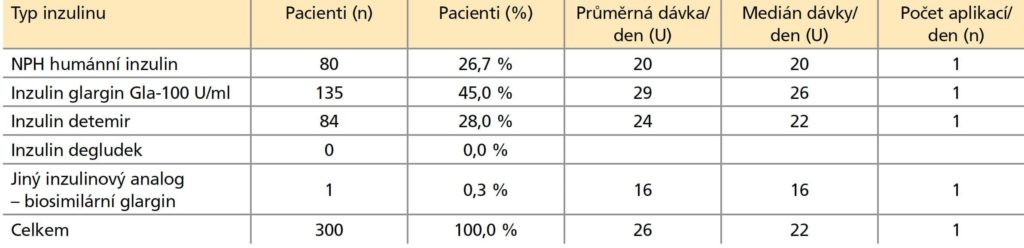 Účinnost léčby Gla-300
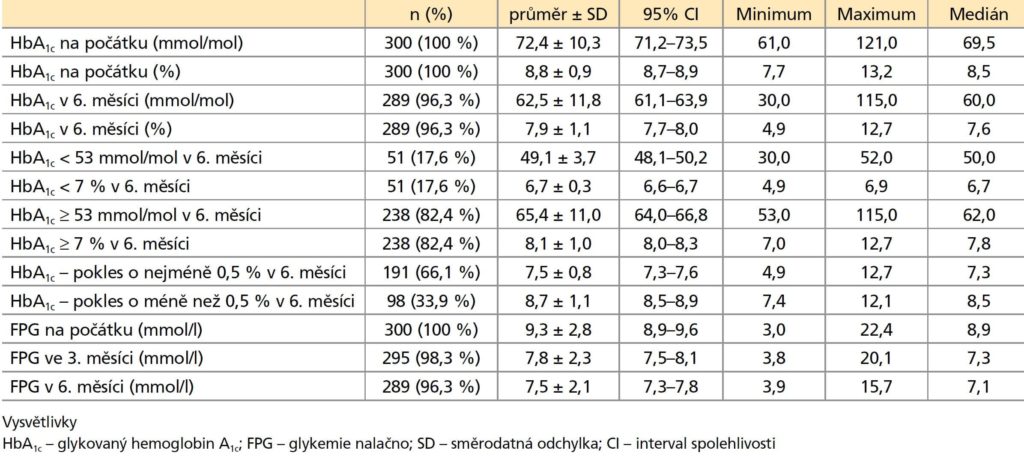
Průměrný HbA1c byl 8,8 ± 0,9 % (72,4 ± 10,3 mmol/mol) na počátku a 7,9 ± 1,1 % (62,5 ± 11,8 mmol/mol) po 6 měsících léčby inzulinem Gla-300 (tabulka 3). Tento pokles HbA1c (průměrná změna –0,9 ± 1,06 % [–9,9 ± 11,6 mmol/mol]) byl statisticky významný (p < 0,0001). Po 6 měsících léčby Gla-300 dosáhlo 17,6 % (51/289) pacientů nedostatečně kompenzovaných při léčbě předchozím bazálním inzulinem cílový HbA1c < 7,0 % (< 53 mmol/mol) (tabulka 3). Průměrná změna HbA1c od počátku do 6. měsíce u pacientů s HbA1c < 7 % byla více než dvojnásobná oproti změně HbA1c u pacientů s HbA1c ≥ 7,0 % (–1,77 ± 0,9 % versus –0,72 ± 1,0 %). Pokles HbA1c od počátku do 6. měsíce o nejméně 0,5 % byl pozorován u 66,1 % (191/289) pacientů (tabulka 3). V této skupině pacientů byla průměrná změna HbA1c –1,47 ± 0,8 %, zatímco ve druhé skupině pacientů se změnou HbA1c pod 0,5 % byla průměrná změna HbA1c +0,2 ± 0,6 %.
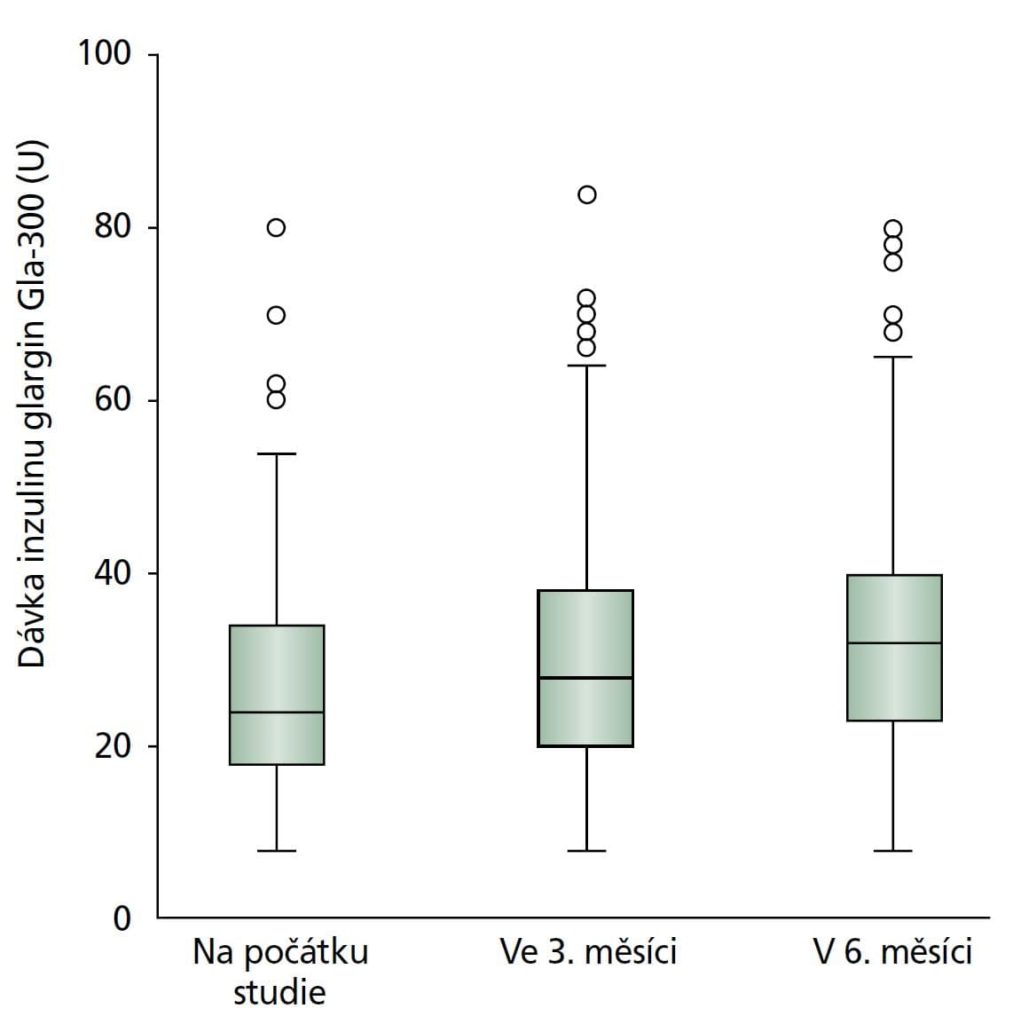
FPG poklesla po 3 měsících léčby Gla-300 (průměrná změna od počátku –1,5 ± 3,0 mmol/l) a setrvala do 6. měsíce (průměrná změna od počátku –1,8 ± 3,1 mmol/l), jak je uvedeno v tabulce 2. Tělesná hmotnost byla během celé studie stabilní, průměrná změna hmotnosti od počátku do 6. měsíce byla 0,09 ± 4,1 kg. Při titraci dávek inzulinu během studie stoupla průměrná denní dávka Gla-300 z 27,1 ± 12,2 U na počátku na 30,9 ± 12,9 U ve 3. měsíci a na 33,7 ± 13,8 U v 6. měsíci (tabulka 3 a doplňující obrázek 1). Průměrná změna denní dávky od počátku do 3. měsíce byla 3,7 ± 5,8 U a od počátku do 6. měsíce 6,6 ± 6,5 U.
Účinnost léčby Gla-300
Průměrný HbA1c byl 8,8 ± 0,9 % (72,4 ± 10,3 mmol/mol) na počátku a 7,9 ± 1,1 % (62,5 ± 11,8 mmol/mol) po 6 měsících léčby inzulinem Gla-300 (tabulka 3). Tento pokles HbA1c (průměrná změna –0,9 ± 1,06 % [–9,9 ± 11,6 mmol/mol]) byl statisticky významný (p < 0,0001). Po 6 měsících léčby Gla-300 dosáhlo 17,6 % (51/289) pacientů nedostatečně kompenzovaných při léčbě předchozím bazálním inzulinem cílový HbA1c < 7,0 % (< 53 mmol/mol) (tabulka 3). Průměrná změna HbA1c od počátku do 6. měsíce u pacientů s HbA1c < 7 % byla více než dvojnásobná oproti změně HbA1c u pacientů s HbA1c ≥ 7,0 % (–1,77 ± 0,9 % versus –0,72 ± 1,0 %). Pokles HbA1c od počátku do 6. měsíce o nejméně 0,5 % byl pozorován u 66,1 % (191/289) pacientů (tabulka 3). V této skupině pacientů byla průměrná změna HbA1c –1,47 ± 0,8 %, zatímco ve druhé skupině pacientů se změnou HbA1c pod 0,5 % byla průměrná změna HbA1c +0,2 ± 0,6 %.
FPG poklesla po 3 měsících léčby Gla-300 (průměrná změna od počátku –1,5 ± 3,0 mmol/l) a setrvala do 6. měsíce (průměrná změna od počátku –1,8 ± 3,1 mmol/l), jak je uvedeno v tabulce 2. Tělesná hmotnost byla během celé studie stabilní, průměrná změna hmotnosti od počátku do 6. měsíce byla 0,09 ± 4,1 kg. Při titraci dávek inzulinu během studie stoupla průměrná denní dávka Gla-300 z 27,1 ± 12,2 U na počátku na 30,9 ± 12,9 U ve 3. měsíci a na 33,7 ± 13,8 U v 6. měsíci (tabulka 3 a doplňující obrázek 1). Průměrná změna denní dávky od počátku do 3. měsíce byla 3,7 ± 5,8 U a od počátku do 6. měsíce 6,6 ± 6,5 U.
Tabulka 3: Přehled hlavních parametrů účinnosti
Obrázek 1: Dávka inzulinu glargin Gla-300 v průběhu trvání studie
Analýza výskytu hypoglykemií byla provedena na souboru pro bezpečnostní analýzu (n = 312). Výskyt hypoglykemií poklesl po změně léčby na Gla-300 o polovinu, jak je uvedeno na obrázku 2. Nejnižší výskyt hypoglykemií byl pozorován v období od počátku do 3. měsíce ve všech hodnocených kategoriích hypoglykemie. Ačkoliv pacienti hlásili hypoglykemii v období od 3. do 6. měsíce častěji, výskyt hypoglykemií ve všech hodnocených kategoriích nedosáhl počtu hypoglykemií na počátku. Rozdíly mezi průměrnými četnostmi výskytu hypoglykemií byly statisticky významné (p < 0,001) s hodnotou 2,10 před počátkem, 1,93 před kontrolou ve 3. měsíci a 1,98 před kontrolou v 6. měsíci (potvrzeno pomocí Friedmanova testu).
Obrázek 2: Výskyt hypoglykemie ve studii TOPAZ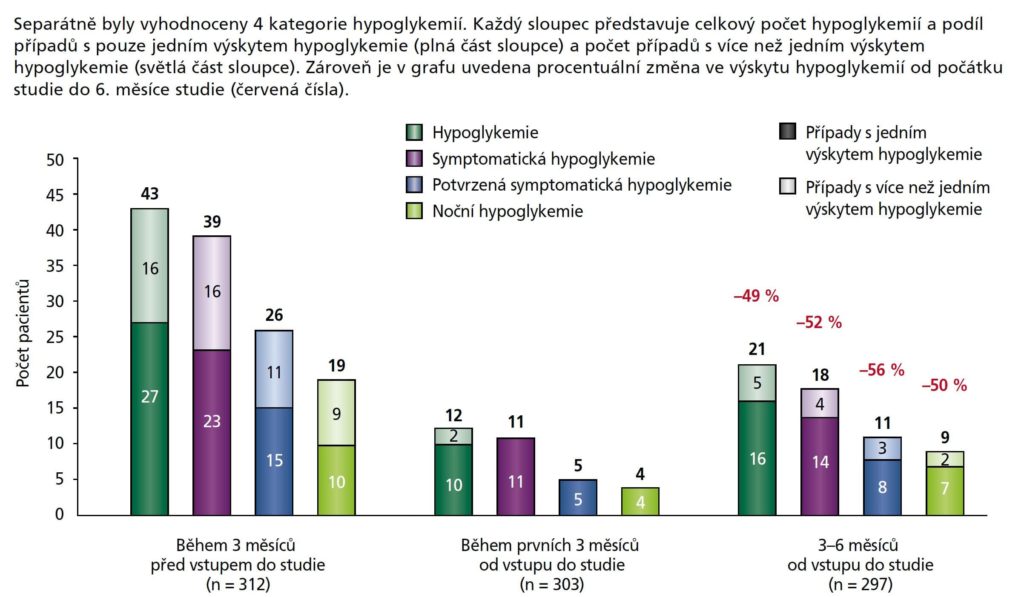
pokojenost pacientů se podle DTSQ po zahájení léčby Gla-300 zvýšila. Nemocní hodnotili na stupnici celkového stavu dle DTSQ svoji spokojenost 23,7 ± 7,5 body (průměr) na počátku, 28,5 ± 5,4 body (průměr) v 6. měsíci a průměrná změna mezi počátkem a 6. měsícem byla 11,1 ± 5,3 bodů (p < 0,0001). Obrázek 3 ukazuje odpovědi na jednotlivé otázky DTSQ na počátku a po 6 měsících léčby Gla-300.
Obrázek 3: Spokojenost pacientů s léčbou (průměry pro otázky v dotazníku DTSQ) na počátku studie a v 6. měsíci studie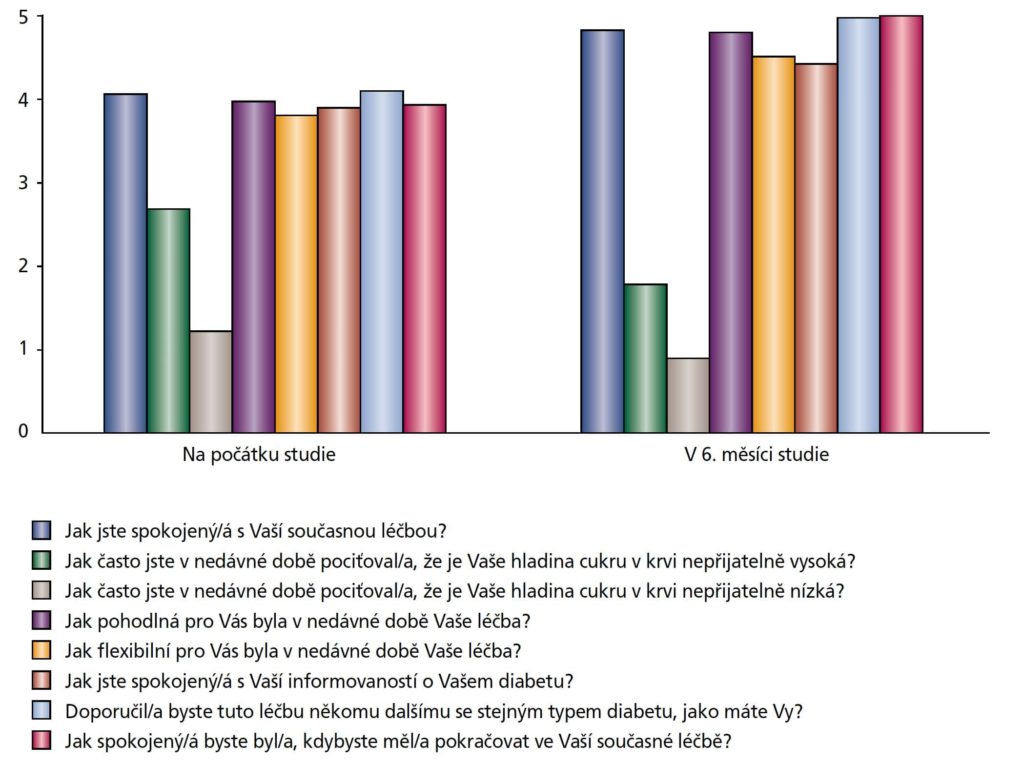 Bezpečnost léčby Gla-300
Celkem bylo během studie u 13 pacientů hlášeno 8 AE (akutní gastroenteritida, bércový vřed, zhoršení kompenzace DM2, nachlazení, chirurgické řešení karpálního tunelu, mikrobiální ekzém, nedostatečný účinek Gla-300, drobná mozková ischemie) a 6 SAE (bazaliom, iktus, hernie v jizvě, embolie a trombóza arterie dolní končetiny, fibrilace síní
a subakutní infarkt myokardu). Jeden pacient prodělal dvě SAE, ale u 95,7 % účastníků studie (287/300) nebyla pozorována žádná AE/SAE. Ze 14 hlášených AE bylo 6 (42,9 %) mírných, 6 (42,9 %) středně závažných a 2 (14,3 %) závažné. Investigátoři označili 2 AE jako vzniklé v souvislosti s léčbou Gla-300 (zhoršení kompenzace DM2 a nedostatečný účinek Gla-300). Tyto 2 AE a 1 SAE (iktus) vedly k přerušení léčby.
Diskuse
Studie z reálné praxe poskytují doplňující informace k výsledkům randomizovaných klinických studií, mohou být lépe zobecnitelné a lépe využitelné pro práci kliniků a pro potřeby zdravotnického systému.18 Tato studie byla navržena ke komplexnímu popisu využití Gla-300 v léčbě DM2 v podmínkách běžné klinické praxe v České republice. Primárním cílem této studie bylo zhodnocení účinnosti a bezpečnosti změny léčby z jiného bazálního inzulinu na Gla-300 v průběhu 6měsíčního sledovaného období u pacientů s DM2.
Výsledky této studie týkající se léčby Gla-300 v podmínkách běžné praxe byly v souladu s výstupy III. fáze klinických studií programu EDITION.10–12 Pokles HbA1c po 6 měsících léčby byl statisticky významný. Po 6 měsících léčby Gla-300 dosáhlo 17,6 % pacientů nedostatečně kompenzovaných při léčbě předchozím bazálním inzulinem cílový HbA1c < 7,0 % (< 53 mmol/mol). Navíc dvě třetiny pacientů měly prospěch z významného poklesu HbA1c, což byla podskupina pacientů, u kterých hodnota HbA1c během 6 měsíců léčby klesla o více než 0,5 %. U pacientů, kteří v 6. měsíci dosáhli doporučené cílové hodnoty HbA1c < 7 % dle ADA a EASD,7 jsme pozorovali více než dvojnásobnou změnu HbA1c ve srovnání s pacienty s HbA1c ≥ 7 %. Během 6 měsíců léčby Gla-300 se příznivě změnily i další klinické parametry.
Podobné cílové parametry a populace jako ve studii TOPAZ byly již dříve hodnoceny v klinické studii EDITION 2, která porovnávala účinnost a bezpečnost Gla-300 s Gla-100 u pacientů s DM2 léčených bazálním inzulinem (≥ 42 U/den) + perorálními antidiabetiky.11 Ve studii EDITION 2 její autoři prokázali pokles HbA1c u pacientů léčených Gla-300. Vedle celkového konceptu klinické studie vs. neintervenční studie z reálné praxe se EDITION 2 od studie TOPAZ lišila průměrnou hodnotou HbA1c na počátku (8,24 % [66,6 mmol/mol] vs. 8,8 % [72,4 mmol/mol]) a v populaci pacientů s a bez léčby perorálními antidiabetiky. V metaanalýze tří klinických studií s Gla-300 (EDITION 1–3) publikované Ritzelem19 byla průměrná změna HbA1c od počátku do 6. měsíce ve skupině léčené inzulinem Gla-300 podobná jako ve studii TOPAZ. Naopak podíl účastníků, kteří dosáhli cílového HbA1c < 7 % (< 53 mmol/mol), byl mnohem vyšší ve studii EDITION 2 (30,6 %) a v metaanalýze (36,2 %)19 než ve studii TOPAZ (17,6 %). Dosažení nižšího cílového HbA1c ve studii TOPAZ mohlo být způsobeno jeho vyšší počáteční hodnotou, neboť kritéria pro zařazení ve studii TOPAZ vyžadovala HbA1c > 7,6 % (> 60 mmol/mol) nebo opakované hypoglykemie při léčbě humánním bazálním inzulinem. Také optimalizace dávky ve studiích treat-to-target nemusí být shodná s reálnou praxí a mohou se zde projevovat i další faktory. Zlepšení FPG a absence vzestupu hmotnosti jsou dalšími klinickými parametry podobnými ve studii EDITION 2,11 metaanalýze19 a studii TOPAZ po 6 měsících léčby Gla-300.
V nedávné době byla Ritzelem20 publikována další meta analýza tří klinických studií EDITION po 12 měsících léčby Gla-300, dle které poklesl průměrný HbA1c od počátku do 12 měsíců o –0,91 % (–9,95 mmol/mol). Ačkoliv dávka Gla-300 po 12 měsících léčby mírně stoupla, klinický prospěch zahrnující snížení rizika hypoglykemie a příznivý bezpečnostní profil Gla-300 byl u pacientů s DM2 během 12 měsíců zachován.20
Zhou et al. publikoval v nedávné době (2018) výsledky retrospektivní kohortové studie porovnávající data z běžné klinické praxe s využitím zdrojů zdravotní péče u pacientů s DM2 léčených bazálním inzulinem, kteří změnili léčbu za Gla-300 nebo za jiný bazální inzulin.14 Autoři uvedli významný pokles HbA1c během 6 měsíců léčby inzulinem, který byl srovnatelný v obou kohortách pacientů (Gla-300 vs. jiný bazální inzulin). Významně méně pacientů léčených Gla-300 prodělalo hypoglykemii ve srovnání s pacienty léčenými jiným bazálním inzulinem. Pacienti převedení na léčbu Gla-300 měli významně nižší četnost využití zdrojů zdravotní péče v souvislosti s hypoglykemií. Léčba Gla-300 byla příznivá i v četnosti hospitalizací z jakýchkoliv příčin, z příčin spojených s diabetem a ve využití zdrojů zdravotní péče na urgentním příjmu. Tyto výsledky jsou v souladu s výsledky studie TOPAZ s výjimkou využití zdrojů zdravotní péče, které nebylo ve studii TOPAZ hodnoceno.14 Nejnižší výskyt hypoglykemií při léčbě Gla-300 vs. jiným bazálním inzulinem v období od počátku do 3. měsíce, tedy po změně inzulinové léčby, je v souladu s výsledky studie BRIGHT, první randomizované kontrolované studie, která přímo porovnávala Gla-300 s inzulinem degludek a ukázala nižší výskyt hypoglykemií ve prospěch Gla-300 během titračního období. Tato studie byla recentně publikována Rosenstockem.21
Dle souhrnu informací o přípravku Gla-300 je hypoglykemie stejně jako u všech ostatních inzulinů běžným vedlejším účinkem léčby.9 Výsledky klinických studií ukázaly, že výskyt prokázaných hypoglykemií byl nižší při užívání Gla-300 ve srovnání s Gla-100 u pacientů s DM2 léčených zmíněným inzulinem v kombinaci s neinzulinovými antidiabetiky (18% pokles rizika) i prandiálním inzulinem (21% pokles rizika).11 Výskyt hypoglykemií ve studii TOPAZ klesl během léčby Gla-300 ve srovnání s počátkem studie a nižší výskyt hypoglykemií přetrvával i během celého sledovaného období, a to až do konce studie.
Výskyt AE/SAE během léčby Gla-300 byl ve studii TOPAZ nízký, hlášeno bylo 8 AE (2,6 % pacientů) a 6 SAE (2,0 % pacientů). 3 pacienti (1,0 %) předčasně přerušili léčbu Gla-300 z důvodu AE/SAE a 2 AE (0,6 %) souvisely podle investigátorů s léčbou Gla-300.
V metaanalýze všech klinických studií s Gla-30019 byly uvedeny celkové četnosti výskytu AE 57,3 % a SAE 5,2 %; 1,4 % pacientů ze studií odstoupilo z důvodu AE/SAE. Ve studii EDITION 211 souviselo 1,7 % AE se studijní léčbou. Ve studii TOPAZ byli investigátoři vyzváni k zaznamenávání všech AE na každé kontrole, jak je uvedeno v protokolu, nicméně péče o pacienty s diabetem je v České republice prováděna z více než 80 % diabetology, nikoliv praktickými lékaři, kteří jsou většinou lépe informováni o všech komorbiditách pacienta a kteří koordinují zdravotní péči poskytovanou pacientovi jinými specialisty. V metaanalýze publikované Ritzelem19 byly nejčastějšími AE poruchy nervového systému, gastrointestinální poruchy, poruchy pojivových tkání a muskuloskeletálního systému, celkové příznaky a komplikace v místě vpichu. Tyto AE se lišily od těch pozorovaných v naší studii. Pouze dvě AE vzniklé při léčbě Gla-300 ve studii TOPAZ souvisely s diabetem (zhoršení kompenzace DM2 a nedostatečný účinek léčby). Celkově nebyly ve studii TOPAZ během léčby zjištěny žádné nové nebo závažné bezpečnostní signály. Studie TOPAZ ukázala vysokou spokojenost pacientů s léčbou podle DTSQ, stejně jako tomu bylo v obou skupinách pacientů léčených Gla-300 a Gla-100 ve studii EDITION 2.11
Je obecně známo, že observační studie mohou přinášet důležité výsledky z běžné klinické praxe, zvláště u velkých souborů pacientů s chronickými onemocněními, jako je DM. Vedle síly předkládaných výsledků má tento prospektivní soubor prezentovaných údajů, které dokládají účinnost a bezpečnost Gla-300, také některá omezení. V observačním nekontrolovaném uspořádání studie není možné rozlišit mezi specifickým účinkem léčby a nespecifickými vlivy v souvislosti se zařazením do studie. Z tohoto důvodu nedeklarujeme příčinnou souvislost mezi uvedenými účinky a změnou léčby za Gla-300 U/ml. Dalším omezením může být nedostatečné uvádění AE včetně hypoglykemií diabetology, nejspíše proto, že účastníci investigátorům nereferovali všechny běžné obtíže nesouvisející s diabetem. Zdravotní obtíže uváděné jako AE v klinických studiích s Gla-30019 a celkové příznaky jsou v České republice nejčastěji konzultovány s praktickými lékaři nebo lékaři jiných specializací.
Výhodou studie TOPAZ je, že většina hodnocených parametrů jsou objektivní klinické laboratorní hodnoty (HbA1c, FPG) nebo parametry (hmotnost, dávka). Navíc byl počet zařazených pacientů dostatečný k zajištění 90% síly analýzy k získání statisticky významného výsledku.
Závěr
Změna inzulinové léčby na bazální inzulinový analog 2. generace Gla-300 U/ml u 300 českých pacientů s DM2 nedostatečně kompenzovaných léčbou jiným bazálním inzulinem vedla ke statisticky a klinicky významnému poklesu HbA1c, nižšímu výskytu hypoglykemií, absenci nárůstu tělesné hmotnosti a ke zvýšení spokojenosti pacientů s léčbou. Naše výsledky naznačují, že příznivé účinky Gla-300 prokázané v randomizovaných kontrolovaných studiích mohou být pozorovány také v podmínkách běžné klinické praxe.
Poděkování
Autoři děkují zúčastněným lékařům za jejich spolupráci na projektu. MUDr. Jaroslav Černý, Ph.D., z AIXIAL s.r.o., financovaný společností Sanofi Praha, Česká republika, a MUDr. Eva Horová, Ph.D., poskytli autorům ediční a autorskou podporu při psaní tohoto rukopisu. Všichni autoři měli plný přístup ke všem údajům ve studii a nesou kompletní zodpovědnost za integritu uvedených údajů a přesnost analýz. Všichni jmenovaní autoři splňují kritéria Mezinárodní komise editorů zdravotnických publikací (ICMJE) pro autorství tohoto článku, nesou zodpovědnost za integritu celé této práce a poskytli svolení k uveřejnění této verze.
Konflikt zájmů
M. P. poskytuje konzultace nebo přednáší pro společnosti Abbott, AstraZeneca, Boehringer Ingelheim, Eli Lilly, Medtronic, Novartis, Novo Nordisk, Roche, Sanofi, Takeda a Teva. P. J. je zaměstnanec a vlastník akcií společnosti Sanofi. J. M. je zaměstnankyně společnosti NEOX Clinical Research – organizace pro klinický výzkum, která poskytuje následující služby financované sponzorem: organizace údajů, statistické analýzy a podpora při psaní rukopisu.
Soulad s Etickými doporučeními
Všechny postupy provedené ve studiích zahrnujících účast lidí byly v souladu s etickými standardy institucionální a/nebo národní komise pro výzkum a s Helsinskou deklarací (1964) i jejími pozdějšími dodatky nebo srovnatelnými etickými standardy. Informovaný souhlas byl získán od všech účastníků zařazených do studie.
Autorské přínosy
M. P. byl hlavním supervizorem studie, podílel se na návrhu uspořádání studie, diskusi a interpretaci údajů, psaní, editaci a kritické revizi rukopisu a poskytl závěrečný souhlas s publikací. M. F. se podílel na návrhu uspořádání studie, vedl klinický výzkum a sbíral data, revidoval a editoval rukopis a poskytl závěrečný souhlas s publikací. P. J. se podílel na návrhu uspořádání studie, získával údaje, revidoval a editoval rukopis a poskytl závěrečný souhlas s publikací. J. M. se podílela na získávání údajů, diskusi a interpretaci výsledků, revidovala a editovala rukopis a poskytla závěrečný souhlas s publikací.
Literatura
Bezpečnost léčby Gla-300
Celkem bylo během studie u 13 pacientů hlášeno 8 AE (akutní gastroenteritida, bércový vřed, zhoršení kompenzace DM2, nachlazení, chirurgické řešení karpálního tunelu, mikrobiální ekzém, nedostatečný účinek Gla-300, drobná mozková ischemie) a 6 SAE (bazaliom, iktus, hernie v jizvě, embolie a trombóza arterie dolní končetiny, fibrilace síní
a subakutní infarkt myokardu). Jeden pacient prodělal dvě SAE, ale u 95,7 % účastníků studie (287/300) nebyla pozorována žádná AE/SAE. Ze 14 hlášených AE bylo 6 (42,9 %) mírných, 6 (42,9 %) středně závažných a 2 (14,3 %) závažné. Investigátoři označili 2 AE jako vzniklé v souvislosti s léčbou Gla-300 (zhoršení kompenzace DM2 a nedostatečný účinek Gla-300). Tyto 2 AE a 1 SAE (iktus) vedly k přerušení léčby.
Diskuse
Studie z reálné praxe poskytují doplňující informace k výsledkům randomizovaných klinických studií, mohou být lépe zobecnitelné a lépe využitelné pro práci kliniků a pro potřeby zdravotnického systému.18 Tato studie byla navržena ke komplexnímu popisu využití Gla-300 v léčbě DM2 v podmínkách běžné klinické praxe v České republice. Primárním cílem této studie bylo zhodnocení účinnosti a bezpečnosti změny léčby z jiného bazálního inzulinu na Gla-300 v průběhu 6měsíčního sledovaného období u pacientů s DM2.
Výsledky této studie týkající se léčby Gla-300 v podmínkách běžné praxe byly v souladu s výstupy III. fáze klinických studií programu EDITION.10–12 Pokles HbA1c po 6 měsících léčby byl statisticky významný. Po 6 měsících léčby Gla-300 dosáhlo 17,6 % pacientů nedostatečně kompenzovaných při léčbě předchozím bazálním inzulinem cílový HbA1c < 7,0 % (< 53 mmol/mol). Navíc dvě třetiny pacientů měly prospěch z významného poklesu HbA1c, což byla podskupina pacientů, u kterých hodnota HbA1c během 6 měsíců léčby klesla o více než 0,5 %. U pacientů, kteří v 6. měsíci dosáhli doporučené cílové hodnoty HbA1c < 7 % dle ADA a EASD,7 jsme pozorovali více než dvojnásobnou změnu HbA1c ve srovnání s pacienty s HbA1c ≥ 7 %. Během 6 měsíců léčby Gla-300 se příznivě změnily i další klinické parametry.
Podobné cílové parametry a populace jako ve studii TOPAZ byly již dříve hodnoceny v klinické studii EDITION 2, která porovnávala účinnost a bezpečnost Gla-300 s Gla-100 u pacientů s DM2 léčených bazálním inzulinem (≥ 42 U/den) + perorálními antidiabetiky.11 Ve studii EDITION 2 její autoři prokázali pokles HbA1c u pacientů léčených Gla-300. Vedle celkového konceptu klinické studie vs. neintervenční studie z reálné praxe se EDITION 2 od studie TOPAZ lišila průměrnou hodnotou HbA1c na počátku (8,24 % [66,6 mmol/mol] vs. 8,8 % [72,4 mmol/mol]) a v populaci pacientů s a bez léčby perorálními antidiabetiky. V metaanalýze tří klinických studií s Gla-300 (EDITION 1–3) publikované Ritzelem19 byla průměrná změna HbA1c od počátku do 6. měsíce ve skupině léčené inzulinem Gla-300 podobná jako ve studii TOPAZ. Naopak podíl účastníků, kteří dosáhli cílového HbA1c < 7 % (< 53 mmol/mol), byl mnohem vyšší ve studii EDITION 2 (30,6 %) a v metaanalýze (36,2 %)19 než ve studii TOPAZ (17,6 %). Dosažení nižšího cílového HbA1c ve studii TOPAZ mohlo být způsobeno jeho vyšší počáteční hodnotou, neboť kritéria pro zařazení ve studii TOPAZ vyžadovala HbA1c > 7,6 % (> 60 mmol/mol) nebo opakované hypoglykemie při léčbě humánním bazálním inzulinem. Také optimalizace dávky ve studiích treat-to-target nemusí být shodná s reálnou praxí a mohou se zde projevovat i další faktory. Zlepšení FPG a absence vzestupu hmotnosti jsou dalšími klinickými parametry podobnými ve studii EDITION 2,11 metaanalýze19 a studii TOPAZ po 6 měsících léčby Gla-300.
V nedávné době byla Ritzelem20 publikována další meta analýza tří klinických studií EDITION po 12 měsících léčby Gla-300, dle které poklesl průměrný HbA1c od počátku do 12 měsíců o –0,91 % (–9,95 mmol/mol). Ačkoliv dávka Gla-300 po 12 měsících léčby mírně stoupla, klinický prospěch zahrnující snížení rizika hypoglykemie a příznivý bezpečnostní profil Gla-300 byl u pacientů s DM2 během 12 měsíců zachován.20
Zhou et al. publikoval v nedávné době (2018) výsledky retrospektivní kohortové studie porovnávající data z běžné klinické praxe s využitím zdrojů zdravotní péče u pacientů s DM2 léčených bazálním inzulinem, kteří změnili léčbu za Gla-300 nebo za jiný bazální inzulin.14 Autoři uvedli významný pokles HbA1c během 6 měsíců léčby inzulinem, který byl srovnatelný v obou kohortách pacientů (Gla-300 vs. jiný bazální inzulin). Významně méně pacientů léčených Gla-300 prodělalo hypoglykemii ve srovnání s pacienty léčenými jiným bazálním inzulinem. Pacienti převedení na léčbu Gla-300 měli významně nižší četnost využití zdrojů zdravotní péče v souvislosti s hypoglykemií. Léčba Gla-300 byla příznivá i v četnosti hospitalizací z jakýchkoliv příčin, z příčin spojených s diabetem a ve využití zdrojů zdravotní péče na urgentním příjmu. Tyto výsledky jsou v souladu s výsledky studie TOPAZ s výjimkou využití zdrojů zdravotní péče, které nebylo ve studii TOPAZ hodnoceno.14 Nejnižší výskyt hypoglykemií při léčbě Gla-300 vs. jiným bazálním inzulinem v období od počátku do 3. měsíce, tedy po změně inzulinové léčby, je v souladu s výsledky studie BRIGHT, první randomizované kontrolované studie, která přímo porovnávala Gla-300 s inzulinem degludek a ukázala nižší výskyt hypoglykemií ve prospěch Gla-300 během titračního období. Tato studie byla recentně publikována Rosenstockem.21
Dle souhrnu informací o přípravku Gla-300 je hypoglykemie stejně jako u všech ostatních inzulinů běžným vedlejším účinkem léčby.9 Výsledky klinických studií ukázaly, že výskyt prokázaných hypoglykemií byl nižší při užívání Gla-300 ve srovnání s Gla-100 u pacientů s DM2 léčených zmíněným inzulinem v kombinaci s neinzulinovými antidiabetiky (18% pokles rizika) i prandiálním inzulinem (21% pokles rizika).11 Výskyt hypoglykemií ve studii TOPAZ klesl během léčby Gla-300 ve srovnání s počátkem studie a nižší výskyt hypoglykemií přetrvával i během celého sledovaného období, a to až do konce studie.
Výskyt AE/SAE během léčby Gla-300 byl ve studii TOPAZ nízký, hlášeno bylo 8 AE (2,6 % pacientů) a 6 SAE (2,0 % pacientů). 3 pacienti (1,0 %) předčasně přerušili léčbu Gla-300 z důvodu AE/SAE a 2 AE (0,6 %) souvisely podle investigátorů s léčbou Gla-300.
V metaanalýze všech klinických studií s Gla-30019 byly uvedeny celkové četnosti výskytu AE 57,3 % a SAE 5,2 %; 1,4 % pacientů ze studií odstoupilo z důvodu AE/SAE. Ve studii EDITION 211 souviselo 1,7 % AE se studijní léčbou. Ve studii TOPAZ byli investigátoři vyzváni k zaznamenávání všech AE na každé kontrole, jak je uvedeno v protokolu, nicméně péče o pacienty s diabetem je v České republice prováděna z více než 80 % diabetology, nikoliv praktickými lékaři, kteří jsou většinou lépe informováni o všech komorbiditách pacienta a kteří koordinují zdravotní péči poskytovanou pacientovi jinými specialisty. V metaanalýze publikované Ritzelem19 byly nejčastějšími AE poruchy nervového systému, gastrointestinální poruchy, poruchy pojivových tkání a muskuloskeletálního systému, celkové příznaky a komplikace v místě vpichu. Tyto AE se lišily od těch pozorovaných v naší studii. Pouze dvě AE vzniklé při léčbě Gla-300 ve studii TOPAZ souvisely s diabetem (zhoršení kompenzace DM2 a nedostatečný účinek léčby). Celkově nebyly ve studii TOPAZ během léčby zjištěny žádné nové nebo závažné bezpečnostní signály. Studie TOPAZ ukázala vysokou spokojenost pacientů s léčbou podle DTSQ, stejně jako tomu bylo v obou skupinách pacientů léčených Gla-300 a Gla-100 ve studii EDITION 2.11
Je obecně známo, že observační studie mohou přinášet důležité výsledky z běžné klinické praxe, zvláště u velkých souborů pacientů s chronickými onemocněními, jako je DM. Vedle síly předkládaných výsledků má tento prospektivní soubor prezentovaných údajů, které dokládají účinnost a bezpečnost Gla-300, také některá omezení. V observačním nekontrolovaném uspořádání studie není možné rozlišit mezi specifickým účinkem léčby a nespecifickými vlivy v souvislosti se zařazením do studie. Z tohoto důvodu nedeklarujeme příčinnou souvislost mezi uvedenými účinky a změnou léčby za Gla-300 U/ml. Dalším omezením může být nedostatečné uvádění AE včetně hypoglykemií diabetology, nejspíše proto, že účastníci investigátorům nereferovali všechny běžné obtíže nesouvisející s diabetem. Zdravotní obtíže uváděné jako AE v klinických studiích s Gla-30019 a celkové příznaky jsou v České republice nejčastěji konzultovány s praktickými lékaři nebo lékaři jiných specializací.
Výhodou studie TOPAZ je, že většina hodnocených parametrů jsou objektivní klinické laboratorní hodnoty (HbA1c, FPG) nebo parametry (hmotnost, dávka). Navíc byl počet zařazených pacientů dostatečný k zajištění 90% síly analýzy k získání statisticky významného výsledku.
Závěr
Změna inzulinové léčby na bazální inzulinový analog 2. generace Gla-300 U/ml u 300 českých pacientů s DM2 nedostatečně kompenzovaných léčbou jiným bazálním inzulinem vedla ke statisticky a klinicky významnému poklesu HbA1c, nižšímu výskytu hypoglykemií, absenci nárůstu tělesné hmotnosti a ke zvýšení spokojenosti pacientů s léčbou. Naše výsledky naznačují, že příznivé účinky Gla-300 prokázané v randomizovaných kontrolovaných studiích mohou být pozorovány také v podmínkách běžné klinické praxe.
Poděkování
Autoři děkují zúčastněným lékařům za jejich spolupráci na projektu. MUDr. Jaroslav Černý, Ph.D., z AIXIAL s.r.o., financovaný společností Sanofi Praha, Česká republika, a MUDr. Eva Horová, Ph.D., poskytli autorům ediční a autorskou podporu při psaní tohoto rukopisu. Všichni autoři měli plný přístup ke všem údajům ve studii a nesou kompletní zodpovědnost za integritu uvedených údajů a přesnost analýz. Všichni jmenovaní autoři splňují kritéria Mezinárodní komise editorů zdravotnických publikací (ICMJE) pro autorství tohoto článku, nesou zodpovědnost za integritu celé této práce a poskytli svolení k uveřejnění této verze.
Konflikt zájmů
M. P. poskytuje konzultace nebo přednáší pro společnosti Abbott, AstraZeneca, Boehringer Ingelheim, Eli Lilly, Medtronic, Novartis, Novo Nordisk, Roche, Sanofi, Takeda a Teva. P. J. je zaměstnanec a vlastník akcií společnosti Sanofi. J. M. je zaměstnankyně společnosti NEOX Clinical Research – organizace pro klinický výzkum, která poskytuje následující služby financované sponzorem: organizace údajů, statistické analýzy a podpora při psaní rukopisu.
Soulad s Etickými doporučeními
Všechny postupy provedené ve studiích zahrnujících účast lidí byly v souladu s etickými standardy institucionální a/nebo národní komise pro výzkum a s Helsinskou deklarací (1964) i jejími pozdějšími dodatky nebo srovnatelnými etickými standardy. Informovaný souhlas byl získán od všech účastníků zařazených do studie.
Autorské přínosy
M. P. byl hlavním supervizorem studie, podílel se na návrhu uspořádání studie, diskusi a interpretaci údajů, psaní, editaci a kritické revizi rukopisu a poskytl závěrečný souhlas s publikací. M. F. se podílel na návrhu uspořádání studie, vedl klinický výzkum a sbíral data, revidoval a editoval rukopis a poskytl závěrečný souhlas s publikací. P. J. se podílel na návrhu uspořádání studie, získával údaje, revidoval a editoval rukopis a poskytl závěrečný souhlas s publikací. J. M. se podílela na získávání údajů, diskusi a interpretaci výsledků, revidovala a editovala rukopis a poskytla závěrečný souhlas s publikací.
Literatura
- Chatterjee S, Khunti K, Davies MJ. Type 2 diabetes. Lancet 2017;389:2239–51.
- Collaboration NRF. Worldwide trends in diabetes since 1980: a pooled analysis of 751 population-based studies with 4.4 million participants. Lancet 2016;387:1513–30.
- Ogurtsova K, da Rocha Fernandes JD, Huang Y, et al. IDF diabetes atlas: global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract 2017;128:40–50.
- Trikkalinou A, Papazafiropoulou AK, Melidonis A. Type 2 diabetes and quality of life. World J Diabetes 2017;8:120–9.
- Mosenzon O, Pollack R, Raz I. Treatment of type 2 diabetes: from “guidelines” to “position statements” and back: recommendations of the Israel National Diabetes Council. Diabetes Care 2016;39(Suppl 2):S146–53.
- Chamberlain JJ, Herman WH, Leal S, et al. Pharmacologic therapy for type 2 diabetes: synopsis of the 2017 American Diabetes Association Standards of Medical Care in Diabetes. Ann Intern Med 2017;166:572–8.
- Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009;32:193–203.
- Davies MJ, D’Alessio DA, Fradkin J, et al. Management of hyperglycemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2018;41:2669–701.
- Toujeo – Souhrn informací o přípravku.
- Riddle MC, Bolli GB, Ziemen M, et al. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 2 diabetes using basal and mealtime insulin: glucose control and hypoglycemia in a 6-month randomized controlled trial (EDITION 1). Diabetes Care 2014;37:2755–62.
- Yki-Jarvinen H, Bergenstal R, Ziemen M, et al. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 2 diabetes using oral agents and basal insulin: glucose control and hypoglycemia in a 6-month randomized controlled trial (EDITION 2). Diabetes Care 2014;37:3235–43.
- Bolli GB, Riddle MC, Bergenstal RM, et al. New insulin glargine 300 U/ml compared with glargine 100 U/ml in insulin-naive people with type 2 diabetes on oral glucose-lowering drugs: a randomized controlled trial (EDITION 3). Diabetes Obes Metab 2015;17:386–94.
- Becker RH, Dahmen R, Bergmann K, et al. New insulin glargine 300 Units . mL-1 provides a more even activity profile and prolonged glycemic control at steady state compared with insulin glargine 100 Units . mL-1. Diabetes Care 2015; 38:637–43.
- Zhou FL, Ye F, Berhanu P, et al. Real-world evidence concerning clinical and economic outcomes of switching to insulin glargine 300 units/mL vs other basal insulins in patients with type 2 diabetes using basal insulin. Diabetes Obes Metab 2018;20:1293–7.
- World Medical Association. World Medical Association declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA 2013;310:2191–4.
- Bradley C. Diabetes treatment satisfaction questionnaire. Change version for use alongside status version provides appropriate solution where ceiling effects occur. Diabetes Care 1999;22:530–2.
- ICH Harmonised Tripartite Guideline. Statistical principles for clinical trials. International Conference on Harmonisation E9 expert working group. Stat Med 1999;18:1905–42.
- Sherman RE, Anderson SA, Dal Pan GJ, et al. Real-world evidence – what is it and what can it tell us? N Engl J Med 2016;375:2293–7.
- Ritzel R, Roussel R, Bolli GB, et al. Patient-level meta-analysis of the EDITION 1, 2 and 3 studies: glycaemic control and hypoglycaemia with new insulin glargine 300 U/ml versus glargine 100 U/ml in people with type 2 diabetes. Diabetes Obes Metab 2015;17:859–67.
- Ritzel R, Roussel R, Giaccari A, et al. Better glycaemic control and less hypoglycaemia with insulin glargine 300 U/mL vs glargine 100 U/mL: 1-year patient-level meta-analysis of the EDITION clinical studies in people with type 2 diabetes. Diabetes Obes Metab 2018;20:541–8.
- Rosenstock J, Cheng A, Ritzel R, et al. More similarities than differences testing insulin glargine 300 Units/mL versus insulin degludec 100 Units/mL in insulin-naive type 2 diabetes: the randomized head-to-head BRIGHT trial. Diabetes Care 2018;41:2147–54.


